Revvity小动物活体光学成像技术已在生命科学基础研究、临床前医学研究及药物 研发等领域得到广泛应用。在众多应用领域中,干细胞研究是活体光学成像技术的应用 热点之一。在活体光学成像实验中,常用于干细胞光学标记的方法包括:1、利用萤火 虫荧光素酶(Firefly Luciferase)作为报告基因,通过转基因技术体外转染干细胞;2、 通过亲脂性荧光染料直接标记干细胞;3、从已构建好的生物发光转基因动物中提取干 细胞,所提取干细胞即具备生物发光特性。总体来说,应用小动物活体光学成像技术进 行干细胞研究主要集中于以下几个方面:1、监测干细胞的移植、存活和增殖;2、示踪 干细胞在体内的分布和迁移;3、多能诱导干细胞、肿瘤干细胞等新兴研究。下面结合 一些具体实例进行阐述:
一.监测干细胞的移植、存活和增殖
干细胞移植在治疗心肌缺血、脊髓损伤、关节炎等多种疾病中发挥重要作用。但是 迄今为止,科学家对干细胞在体内的存活时间和增殖规律并未完全了解,而缺少有效的 技术手段是其中一个重要限制因素。活体光学成像技术可以长期连续监测干细胞在活体 动物体内的存活及增殖规律,为干细胞的研究提供了全新的技术支持。以下为应用生物 发光成像技术观测干细胞在活体动物体内存活和增殖的具体实例:
造血干细胞移植是现代生命科学的重大突破,通过移植造血干细胞可以治疗恶性 血液病,部分恶性肿瘤,部分遗传性疾病等多种致死性疾病。之前对于造血干细胞的 异体移植研究主要依靠流式细胞仪分析从处死的受体动物中提取的骨髓。这种方法虽然 能够准确测量造血干细胞的移植存活率,但存在诸多缺陷:如需处死大批实验动物;无 法反映除骨髓之外其他部位发生的造血重组情况;数据获取只局限于处死动物后的单一 时间点,无法对同一个体的移植情况进行连续纵向观测。生物发光成像技术很好的解决 了上述问题。发表于2003年Blood杂志上的一篇文献首次利用了生物发光技术进行干 细胞异体移植的研究。作者观察了不同造血干细胞(CD34+,CD34+CD38-)移植后,在 体内表现出的不同增值规律:前者在移植8天后快速增殖,22天后细胞数量急剧下降; 后者移植后一直处于增殖状态。研究者认为该技术是研究干细胞异体移植后的迁移和增 殖规律的有力工具,同时是研究不同细胞群体在体内增殖不同表现的最佳选择。
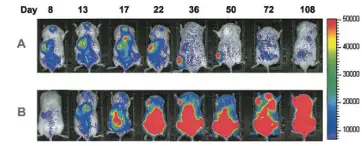
将生物发光标记的人造血干细胞 CD34+(A) 或CD34+CD38-(B)经尾 静脉移植入NOD/SCID小鼠体内, 应用IVIS成像系统长时间观测上 述细胞在小鼠体内的存活及增殖 情况。
肌肉卫星细胞(Adultmuscle satellite cells)是骨骼肌中位于肌细胞膜和基膜之间 的具有增殖分化潜力的肌源性细胞。它们在一般情况下处于静息状态,当被激活后, 具有增殖分化、融合成肌管、再形成肌细胞的能力。因此,肌肉卫星细胞被认为是一 种干细胞,但卫星细胞群的混合性质意味着它们的干细胞身份难以证明。发表于2008 年Nature 上的一篇文献通过利用生物发光成像技术证实卫星细胞的确是干细胞、能够 自我更新,从而澄清了相关问题。研究者将生物发光标记的单个肌肉卫星细胞移植入 NOD/SCID 小鼠胫骨前肌中,4周后利用IVIS成像系统进行观测,发现它能够存活并 大量增殖,而且可以被再次移植。
上图上:移植单个肌肉卫星细胞实验流程示意图;上图下:利用IVIS系统观测单个细胞移植4周后的存活及增殖情况,72只移植小鼠中有3只成功移植了单个干细胞。
应用干细胞进行疾病治疗的一个重要前提是能够成功接种干细胞,并且干细胞移植 后在受体动物体内能够稳定存活。为此,科研人员一直致力于通过各种途径提高干细胞 的在体存活率
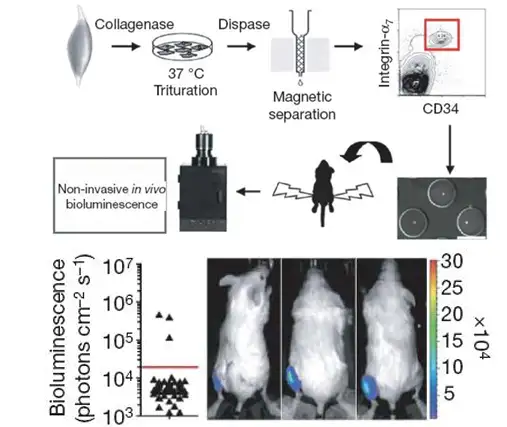
在利用干细胞修复梗阻心肌的实验中,通常是将相互离散的干细胞直接注入心肌 内,这会很容易造成相互离散的干细胞由于注射点渗血或心脏收缩而被排出,以及射入 细胞的急性死亡,都会导致心肌内干细胞的存留及存活率下降。2011年Biomaterials上 一篇文献针对上述问题提出了解决方案。研究者摒弃了直接将相互离散的干细胞注入心 肌的方式,而是首先利用甲基纤维素水凝胶对生物发光标记的人羊水干细胞(hAFSC) 进行体外培养,使相互离散的干细胞形成球面对称的细胞体,然后再将细胞体注入心肌。 结果显示,与直接注射离散细胞相比,注射细胞体能够有效提高干细胞的移植率和存活 率。导致这一结果的原因是细胞体相对于离散细胞具有更有效的物理体积,因而更容易 存留于心肌间隙,一旦进入心肌间隙,细胞体中富集的内源性胞外基质和粘附分子便可 提供良好的微环境使移植细胞存活于受体中。
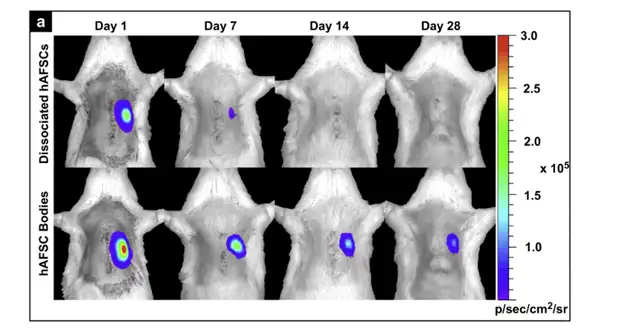
上图:应用IVIS成像系统观测生物发光标记的人羊水干细胞在免疫缺陷型大鼠心肌移植的情况。上列:直接注入离散细胞;下列:体外培养形成细胞体后再注入。
另一篇文献报道了利用生物材料提高干细胞的移植存活率。研究者将人工基质胶 (Matrigel)、胶原蛋白(Collagen 1)、肽段水凝胶(Puramatrix)及上述三种物质的混 合物分别与生物发光标记的骨髓间充质干细胞混合接种于无胸腺裸鼠背部皮下,利用 IVIS 成像系统长时间观测三种生物材料对干细胞体内存活的影响。结果显示,人工基质 胶能够明显提高干细胞的移植存活率。原因可能是基质胶中的基膜蛋白能够释放各种生 长因子,为细胞的增殖分化提供良好的微环境,同时基质胶本身为细胞提供了支撑架构。
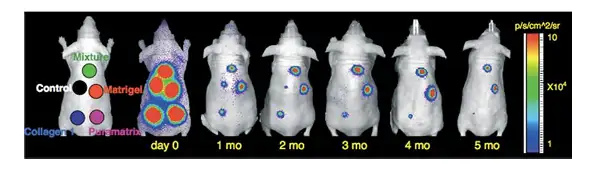
上图:利用IVIS成像系统长时间观测三种生物材料对干细胞体内存活的影响。
二.示踪干细胞在体内的分布和迁移
干细胞移植后,活体示踪干细胞的分布和迁徙具有重要意义。通过示踪,不仅可以 直观地了解其在体内的分布,而且可以追踪到其体内的分化转归及调控机制。核素成像、 磁共振成像、光学成像等分子影像学技术的发展使干细胞活体示踪成为可能。但通过放 射性核素或磁性颗粒标记干细胞进行活体示踪时,由于核素的快速衰减或磁性颗粒无法 随细胞分裂而保留等缺陷,导致无法在体内对干细胞进行长期示踪。而生物发光成像技 术是利用荧光素酶基因稳定转染干细胞,报告基因不随干细胞的分裂或分化而丢失,因 此,利用这种技术可以长期稳定地观测干细胞在体内的分布和迁移。
2007 年Stem Cell 上的一篇文献即利用生物发光成像技术对骨髓间充质干细胞靶向 迁移至受损心脏进行了长期观测。研究者从生物发光转基因小鼠中提取获得具有生物发 光特性的骨髓间充质干细胞,随后经尾静脉注射入心脏缺血的同品系小鼠体内,利用 IVIS 成像系统对干细胞的分布和迁移进行长达28天的活体观测,发现干细胞会特异性 迁移至受损心脏并存留于心肌中发挥修复功能。
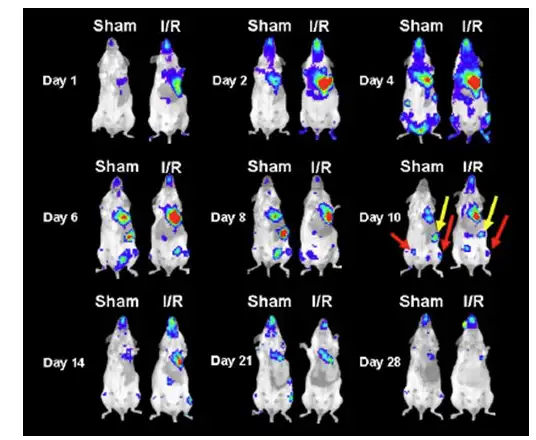
上图:利用IVIS系统观测生物发光标记的骨髓间充质干细胞经尾静脉移植后在心脏缺血再灌注小鼠体内的迁移分布情况。Sham代表经假手术处理的对照小鼠;I/R代表心脏缺血再灌注小鼠。第10天结果显示干细胞除了迁移至心脏外,还分布于脾(黄色箭头)、下肢骨(红色箭头)等部位。
神经干细胞增殖及迁移的缺陷是造成帕金森氏病等神经退行性疾病的主要原因。神 经干细胞起源于侧脑室外侧壁的室管膜下层区域(subventricular zone,SVZ)与海马齿 状回(dentate gyrus,DG),之后通过嘴侧迁移流(rostral migratory stream,RMS)到 达嗅球(olfactory bulb,OB),进一步分化为中枢神经细胞并融入现有的神经通路。2008 年发表于Stem Cell上的一篇文献报道了利用生物发光成像技术观测神经干细胞的上述 迁移情况。如下图所示:
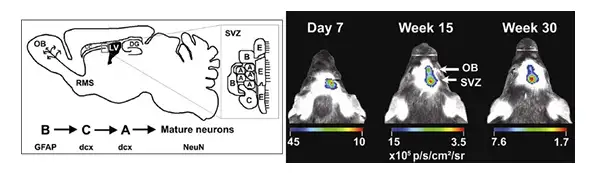
上图左:神经干细胞迁移示意图;上图右:将经生物发光标记的神经干细胞直接注入小鼠颅内SVZ区域,利用IVIS系统观测神经干细胞在颅内的迁移。
应用干细胞治疗癌症是肿瘤治疗的新方法。进行干细胞肿瘤治疗的前提是干细胞移 植后能够靶向迁移至肿瘤细胞。应用活体光学成像技术能够有效观测干细胞在活体动物 体内对肿瘤的靶向迁移。2009年发表于Stem Cell上的一篇研究结果即是一个很好的例 证。研究者分别利用海肾荧光素酶基因(Renilla Luciferase)及萤火虫荧光素酶基因 (Firefly Luciferase),标记鼠乳腺癌细胞株4T1及人骨髓间充质干细胞,利用IVIS成 像系统观测经尾静脉移植的骨髓间充质干细胞靶向乳腺癌肿瘤的情况,如下图所示:
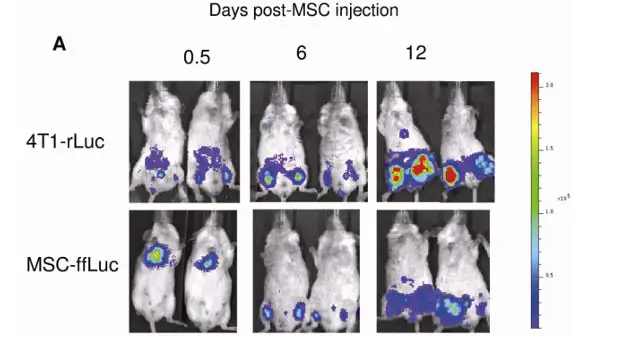
上图:第一行为通过海肾荧光素酶标记肿瘤细胞而观测肿瘤信号;第二行为通过萤火虫荧光素酶标记间充质干细胞示踪干细胞对肿瘤的靶向。注射后0.5天,MSC主要集中于肺部,随着天数的增加,逐渐迁移至肿瘤区域。
上述实例描述了应用荧光素酶基因标记干细胞而对其在体内的分布迁移进行长期 示踪,另一种用于标记干细胞的方式是过亲脂性荧光染料(如DiD、DiR)直接标记干 细胞。相对于前种方式,应用荧光标记的方式示踪干细胞只限于短期观测,这是因为这 些亲脂性荧光染料是通过嵌入细胞膜而标记细胞,因此无法随细胞传代,并且荧光染料 的发光强度也会逐渐减弱。但是,应用荧光染料进行标记,标记过程更易于操作,且具 有转化医学的应用潜力。因此,也有不少研究者通过这种方式监测干细胞在体内的分布 迁移情况。下述例子中,研究者利用 DiD 亲脂性荧光染料标记人骨髓间充质干细胞 (hMSC),将细胞腹腔注射入经抗原诱导而患有关节炎的无胸腺大鼠中,应用IVIS成 像系统观测hMSC在体内的分布及迁移。结果显示,注射后早期,hMSC主要富集于腹 腔,而随着时间的延长,细胞逐渐迁移至患有关节炎的踝关节处。
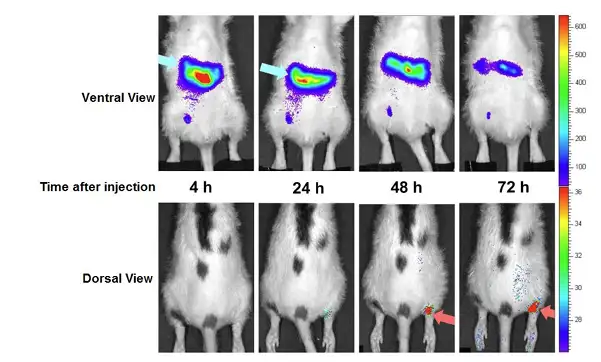
上图:应用IVIS成像系统观测hMSC在患有关节炎的无胸腺大鼠体内的分布及迁移。
三.新兴研究
活体光学成像技术在传统意义干细胞的研究中已得到广泛应用。随着干细胞研究程 度的深入,研究者已开始将该技术应用于干细胞的一些新兴研究领域,如诱导性多能干 细胞(Induced Pluripotent Stem Cells,iPSCs)及肿瘤干细胞(Cancer/Tumor Stem Cell, CSC/TSC)的研究。
诱导性多能干细胞研究
诱导性多能干细胞最初是日本科学家山中申弥(Shinya Yamanaka)于2006年利用 病毒载体将四个转录因子(Oct4, Sox2, Klf4 和c-Myc)的组合引入小鼠成纤维细胞中, 使其重编程而得到的类似胚胎干细胞的一种细胞类型。虽然将诱导性多能干细胞应用于 临床治疗仍存在诸多不确定因素(如致癌副作用、自体免疫排斥等),但相对于在胚胎 干细胞应用中产生的伦理争议,诱导性多能干细胞由于是对成体细胞进行重编程而获 得,因此不存在这方面的问题,使其应用前景更为光明。
近年来,研究者已陆续开始利用小动物活体光学成像技术进行诱导性多能干细胞的 相关研究。发表于2009年Circulation 的一篇文献报道,将经荧光素酶标记的由小鼠成 纤维细胞诱导获取的诱导性多能干细胞,移植入免疫缺陷型裸鼠或具有免疫活性的同种 异体小鼠皮下,发现在后者中不会形成畸胎瘤。进一步的研究显示将诱导性多能干细胞 移植入发生急性心肌梗塞的具有免疫活性的同种异体小鼠心脏后,细胞的发展不会导致 畸胎瘤的形成,能够稳定存活,并能修复受损的心脏。
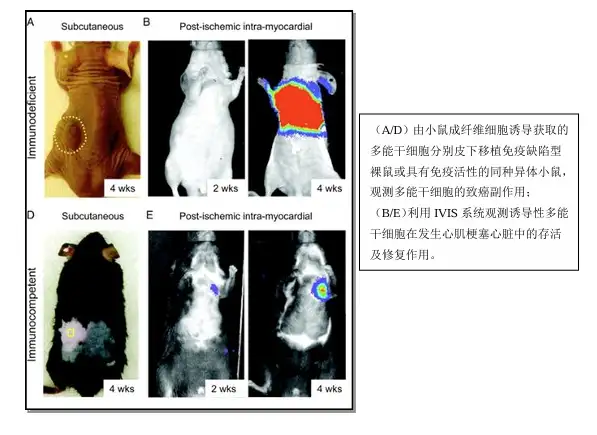
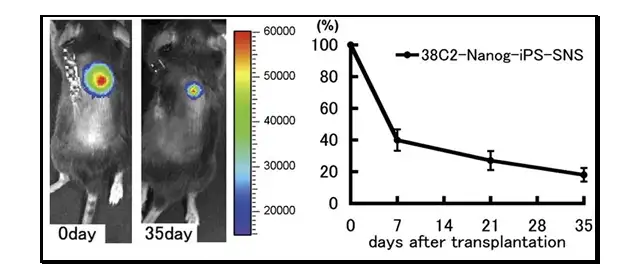
另一篇发表于2010年PNAS的文献报道了应用IVIS成像系统观测由iPS形成的神 经球在脊髓损伤小鼠体内的移植、存活和修复作用。
肿瘤干细胞研究
肿瘤干细胞研究 传统观念认为,肿瘤是由体细胞突变而成,每个肿瘤细胞都可以无限制地生长,但 这无法解释肿瘤细胞似乎具有无限的生命力以及并非所有肿瘤细胞都能无限制生长的 现象。而肿瘤细胞生长、转移和复发的特点与干细胞的基本特性十分相似,因此,有学 者提出肿瘤干细胞的理论,认为肿瘤中一小部分细胞具有自我更新、增殖和分化的潜能, 虽然数量少,却在肿瘤的发生、发展、复发和转移中起着重要作用。从本质上讲,肿瘤 干细胞通过自我更新和无限增殖维持着肿瘤细胞群的生命力;肿瘤干细胞的运动和迁徙 能力又使肿瘤细胞的转移成为可能;肿瘤干细胞可以长时间处于休眠状态并具有多种耐 药分子而对杀伤肿瘤细胞的外界理化因素不敏感,因此肿瘤往往在常规治疗方法消灭大 部分普通肿瘤细胞后一段时间复发。这一理论为我们重新认识肿瘤的起源和本质,以及 临床肿瘤治疗提供了新的方向。
近年来,研究者已陆续开始利用小动物活体光学成像技术进行肿瘤干细胞的相关研 究。在肿瘤干细胞的鉴定方面,研究者可利用活体光学成像技术在活体动物水平观测某 些细胞的致瘤性,以确定该种细胞是否具备肿瘤干细胞的特性。如在2010年的一篇文 献报道中,研究者利用荧光素酶通过慢病毒转染的方式标记了乳腺癌细胞株HCC1954, 并利用流式细胞分选技术分离出带有不同细胞表面标识物 CD24-/low/CD44+及 CD24+/CD44+的两种细胞群,而CD24-/low/CD44+被报道存在于多种乳腺癌干细胞表面, 因此,研究者进一步将两种细胞分别接种于NOD/SICD小鼠身体两侧的乳腺脂肪垫,利 用IVIS 成像系统观测它们的致瘤性。结果显示,带有表面标识物CD24-/low/CD44+的细 胞其致瘤性明显高于 CD24+/CD44+细胞,并且当细胞接种数量少于 100 个时,只有 CD24-/low/CD44+细胞具备致瘤性,说明带有CD24-/low/CD44+的细胞群中可能富含肿瘤干 细胞。
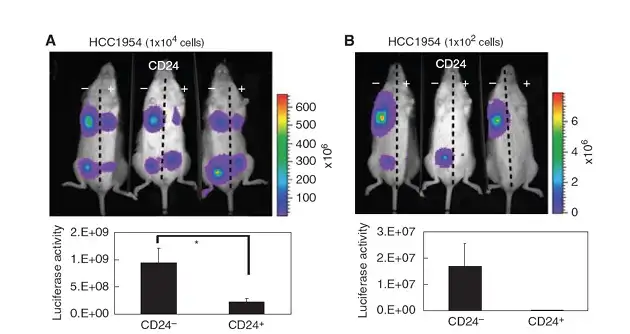
上图:利用IVIS系统观测带有不同细胞表面标识物的HCC1954乳腺癌细胞的致瘤性。A.细胞接种数量为1×104个;B.细胞接种数量为1×102个。
传统的化疗药物主要是通过筛选能杀灭分裂中肿瘤细胞的化合物,而肿瘤干细胞理 论认为,只要存在肿瘤干细胞,肿瘤就不可能治愈。所以,肿瘤治疗的焦点是杀伤肿瘤 干细胞。但是肿瘤干细胞通常处于静止状态,只是在增殖时才开始快速分裂产生子细胞, 所以,按照传统方法筛选出来的肿瘤治疗药物与杀灭肿瘤干细胞的要求差异巨大。2011 年发表于 Cell 的一篇文献报道了根据神经胶质瘤干细胞的增殖特性而利用针对性药物 对肿瘤进行治疗。研究者发现神经胶质瘤干细胞的增殖依赖于一氧化氮合成酶 2 (NOS2),而普通神经胶质瘤细胞或正常神经干细胞的增殖均不依赖NOS2,因此,研 究者设计出一个专门针对NOS2的抑制剂,此抑制剂能够很好地穿过血脑屏障进入颅内 移植的神经胶质瘤,并对荧光素酶标记的神经胶质瘤的生长具有明显抑制效果。同时, 经抑制剂处理的神经胶质瘤干细胞其致瘤性也大幅降低。
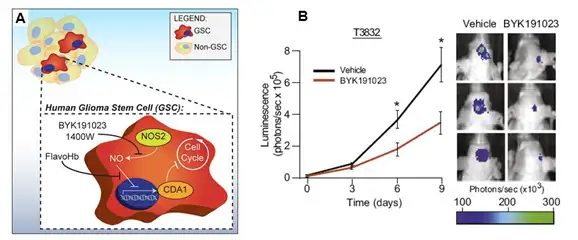
A.神经胶质瘤干细胞的增殖依赖于一氧化氮合成酶2(NOS2)示意图;B.利用IVIS系统观测NOS2抑制剂BYK191023 对神经胶质瘤生长的抑制。