细胞有很多种死亡方式,包括凋亡、自噬和坏死。近年来,“铁死亡”(ferroptosis)作为一种新的细胞坏死方式逐渐进入了人们的眼帘。不同于通常的细胞坏死,铁死亡是一种受调控的坏死过程。
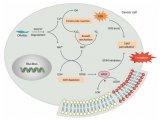
铁死亡是由于膜脂修复酶——谷胱甘肽过氧化物酶(GPX4)失效,造成膜脂上活性氧自由基(ROS)的积累所致,而这一积累过程需要铁离子的参与。多种物质和外界条件可引发铁死亡。小分子erastin通过抑制质膜上的胱氨酸-谷氨酸交换体,降低了细胞对胱氨酸的获取,使得GPX4的底物——谷胱甘肽合成受阻,进而引发膜脂ROS的积累和铁死亡。此外,另一种小分子RSL3作为GPX4的抑制剂也可引发铁死亡。当GPX4基因被敲除后,小鼠会因出现肾衰竭而死亡。
铁死亡与肿瘤抑制、神经元退化、抗病毒免疫反应和缺血-再灌注损伤等多种生理和病理过程有关。站在药物研发的角度,我们可以促进铁死亡,以清除有害的癌细胞、病毒感染的细胞等;或者抑制铁死亡,以保护健康细胞。当然,这一切可能的治疗思路都需建立在对铁死亡机理的理解上。
最近,德国亥姆霍兹慕尼黑中心(Helmholtz Zentrum München)的科学家们发现了铁死亡发生过程中的一个关键蛋白——ACSL4,并且找到了能够有效抑制铁死亡过程的小分子抑制剂。他们的成果发表在近期的《自然》子刊《Nature Chemical Biology》上。
研究人员首先以小鼠胚胎成纤维细胞(MEF)为实验对象,发现当ACSL4基因被敲除后,上述细胞在RSL3的诱导下便不会再发生铁死亡。ACSL4是长链脂酰CoA合成酶(ACSL)家族的一员,在体内催化合成脂酰CoA,作为脂肪酸分解代谢的第一步反应。不同于ACSL4,在MEF中敲除ACSL家族的其他酶并不会引起铁死亡。
ACSL4在功能上有什么特别之处呢?原来,ACSL4将长链多不饱和脂肪酸活化,以参与膜磷脂的合成。其中,ACSL4能将花生四烯酸和肾上腺酸分别合成为花生四烯酰CoA和肾上腺酰CoA,以使其参与磷脂酰乙醇胺或磷脂酰肌醇等带负电膜磷脂的合成,成为其一部分。这些膜上的长链多不饱和脂肪酸常常可被氧化,特别是在RSL3等因素的诱导下,从而引发细胞的铁死亡。