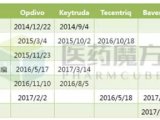
德国制药巨头默克(Merck KGaA)与美国制药巨头辉瑞(Pfizer)合作开发的PD-L1免疫疗法avelumab近日在美国监管方面传来喜讯。美国食品和药物管理局(FDA)已正式受理avelumab治疗转移性默克尔细胞癌(merkel cell carcinoma,MCC)的生物制品许可申请(BLA),同时还授予了优先审查资格(Priority Review designation),其审查周期将从常规的10个月缩短至6个月,这也意味着avelumab在监管批文方面有望在6个月内实现“零”的突破。
Avelumab是一种实验性免疫疗法,之前还获得了FDA的突破性药物资格、快速通道地位、孤儿药地位。默克尔细胞癌(MCC)是一种罕见的侵袭性皮肤癌,预后极差,5年生存率不足20%。在美国,每年新增大约1500例MCC病例;在欧洲,每年新增约2500例MCC病例。目前,在临床上,尽管早期阶段的MCC可通过手术切除,但尚无药物获批用于转移性MCC的治疗,因此该领域存在着显著未获满足的巨大医疗需求。如果获批,avelumab将成为全球首个治疗转移性默克尔细胞癌(MCC)的PD-1/PD-L1免疫疗法。
在欧洲监管方面,欧洲药品管理局(EMA)于本月初正式受理了avelumab的上市许可申请(MAA)。此次MAA,寻求批准avelumab用于既往已接受至少一种化疗方案的转移性默克尔细胞癌(MCC)患者的治疗。
Avelumab BLA和MAA的提交,是基于一项全球II期临床研究(JAVELIN Merkel 200)的数据。该研究是一项多中心、单臂、开放标签研究,在88例既往已接受至少一种化疗方案后病情进展的转移性MCC患者中开展,调查了avelumab的疗效和安全性。数据显示,88例患者接受avelumab治疗后,有28例实现了客观缓解(ORR=31.8%),其中8例完全缓解,20例部分缓解。
PD-1/PD-L1免疫疗法是当前备受瞩目的新一类肿瘤免疫疗法,旨在利用人体自身的免疫系统抵御癌症,通过阻断PD-1/PD-L1信号通路使癌细胞死亡,具有治疗多种类型肿瘤的潜力,有望实质性改善患者总生存期(OS)。当前,PD-1/PD-L1免疫竞赛异常激烈,市场峰值高达350亿美元,该领域的佼佼者包括百时美施贵宝、默沙东、罗氏、阿斯利康。
辉瑞于2014年11月与默克签署了高达28.5亿美元的合作协议,正式宣布进入PD-1/PD-L1免疫治疗领域。面对百时美等强敌,辉瑞与默克采取双管齐下的战略:一方面,avelumab首发针对竞争对手尚未涉及的癌症领域,如默克尔细胞癌(MCC)和胃癌;另一方面,针对对手已经涉足的领域,avelumab将做一个“聪明的追随着”,以分化试验设计、使用生物标记物及组合疗法等方式与之争一席之地。
目前,avelumab的临床开发项目涉及超过15种肿瘤类型,包括乳腺癌、胃癌/胃食管交界腺癌、头颈部癌、MCC、间皮瘤、黑色素瘤、非小细胞肺癌、卵巢癌、肾癌及膀胱癌等。