2023-3-07 11:46
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
此前,我们分享了m6A RNA甲基化研究的数据挖掘思路(点击查看详情),进而筛选出m6A修饰目标基因。
做完MeRIP-seq测序后,如果需要对分析结果中感兴趣的内容进行后期验证,则需要进行下游实验设计。m6A RNA甲基化修饰目标基因的进一步验证或后期试验包括以下6个方面:
简单验证
全局m6A甲基化干扰实验(非靶向),验证m6A甲基化书否真的影响目标基因表达和细胞功能
靶向目标基因的甲基化/去甲基化实验,检测某区域m6A修饰是否真的影响目标基因的表达
研究目标基因的m6A甲基化如何影响目标基因表达
m6A修饰目标基因的表达回复实验
研究特定m6A Readers通过结合目标基因RNA而影响目标基因的蛋白表达
(1)简单验证
目标基因m6A甲基化的验证:MeRIP-RT-PCR
检测目标基因的mRNA表达水平:RT-qPCR
检测目标基因蛋白质表达水平:Western blot
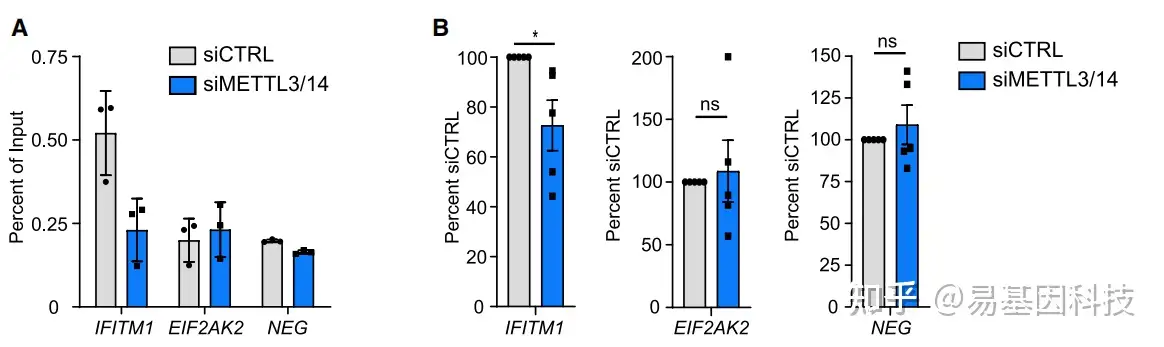
(2)全局m6A甲基化干扰实验(非靶向),验证m6A甲基化书否真的影响目标基因表达和细胞功能
m6A甲基化干扰:m6A writers/erasers的突变/敲降/敲除/过表达、m6A甲基化抑制剂如环亮氨酸、m6A去甲基化抑制剂如FTO抑制剂FB23-2
检测m6A甲基化整体变化:m6A甲基化免疫荧光染色(定性)、m6A斑点杂交(定性)、比色法(定量)、质谱法(定量)
检测目标基因的m6A甲基化变化:MeRIP-qPCR
检测目标基因的mRNA水平:RT-qPCR
检测目标基因蛋白质水平:Western blot
检测细胞功能/表型变化
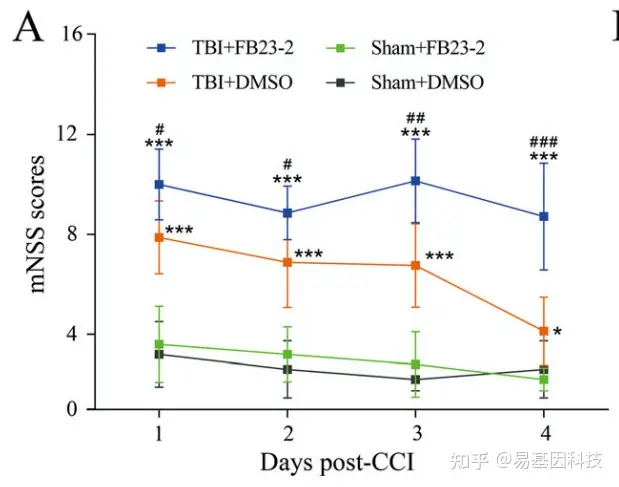
FB23-2给药后,大脑损伤组神经功能缺陷评分显著变差
(3)靶向目标基因的甲基化/去甲基化实验,检测某区域m6A修饰是否真的影响目标基因的表达
目的基因m6A甲基化干扰细胞系的构建:荧光素酶活性分析实验(Luciferase activity assay)——构建含甲基化/未甲基化m6A位点的目标基因-荧光素酶表达质粒,转染细胞并表达。
检测目标基因的m6A甲基化变化:MeRIP-qPCR
检测荧光素酶报告基因的mRNA表达水平:RT-qPCR
检测目标基因蛋白质表达水平:Western blot
检测细胞功能受到的影响:免疫荧光显微观察、功能标志物测定... ...
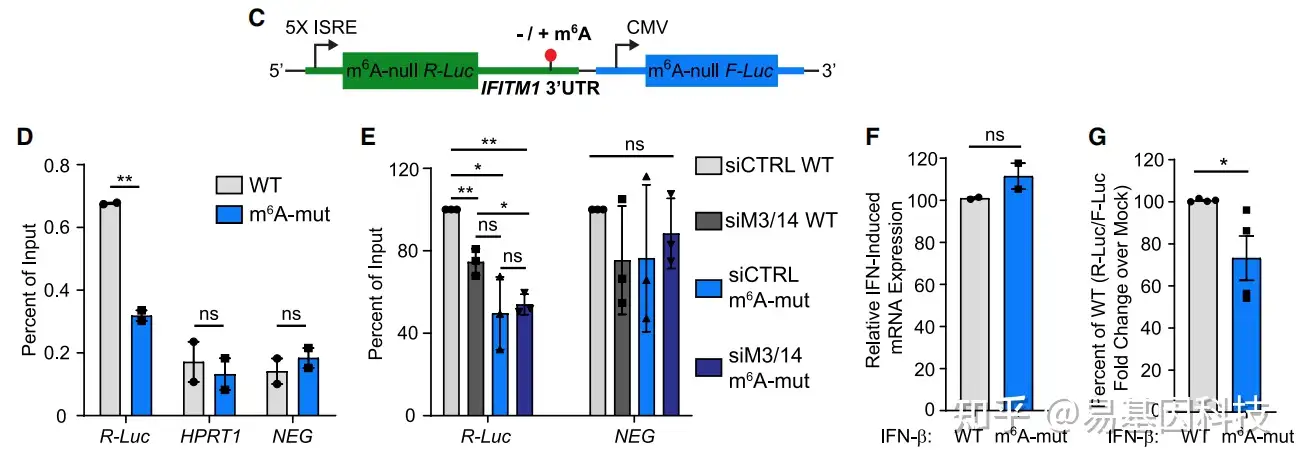
用于验证目标基因上m6A甲基化功能的双荧光素酶报告系统
(4)研究目标基因的m6A甲基化如何影响目标基因表达
检测m6A是否通过影响目标基因翻译而影响蛋白质水平:Polysome profilingRibo-seq通过对结合核糖体上的mRNA进行定量,分析目标基因的蛋白翻译效率
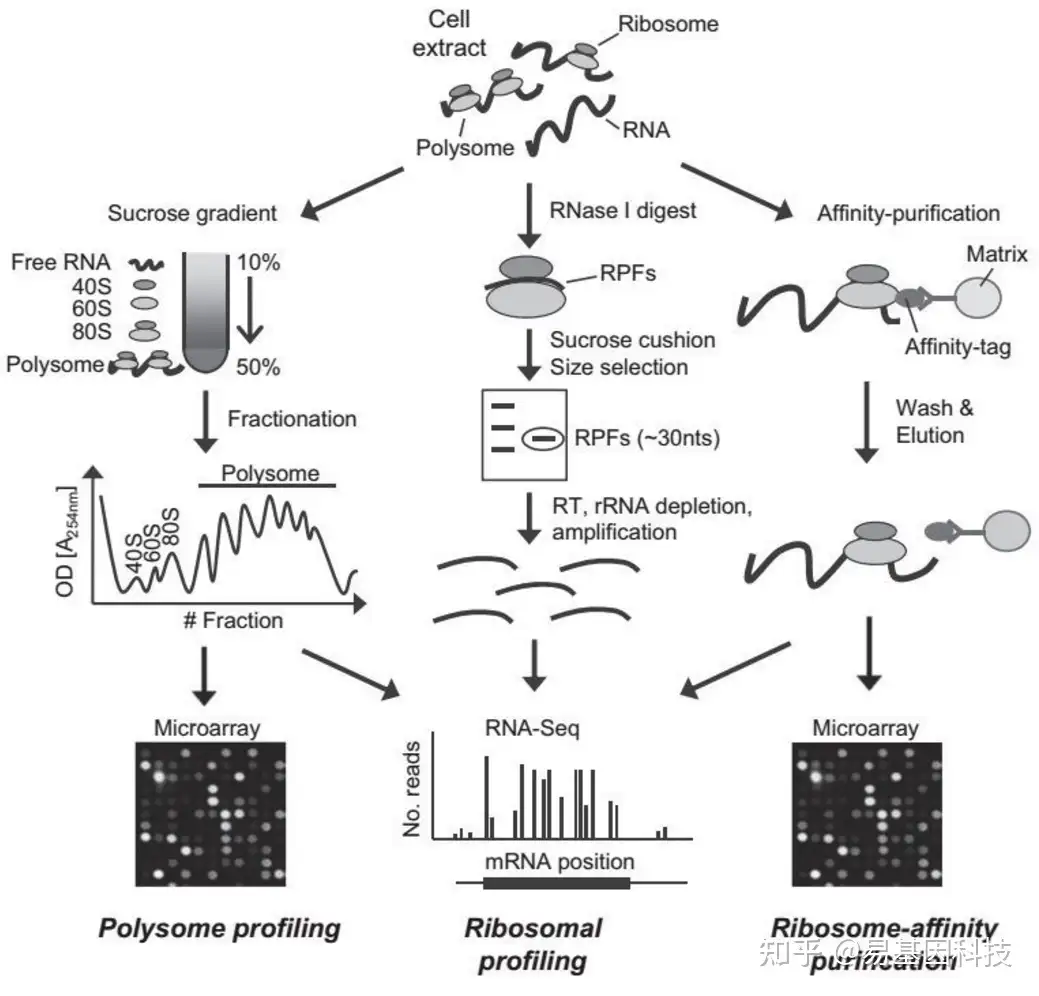
通过对结合核糖体上的mRNA进行定量,分析目标基因的蛋白翻译效率
Polysome Profiling方法举例:
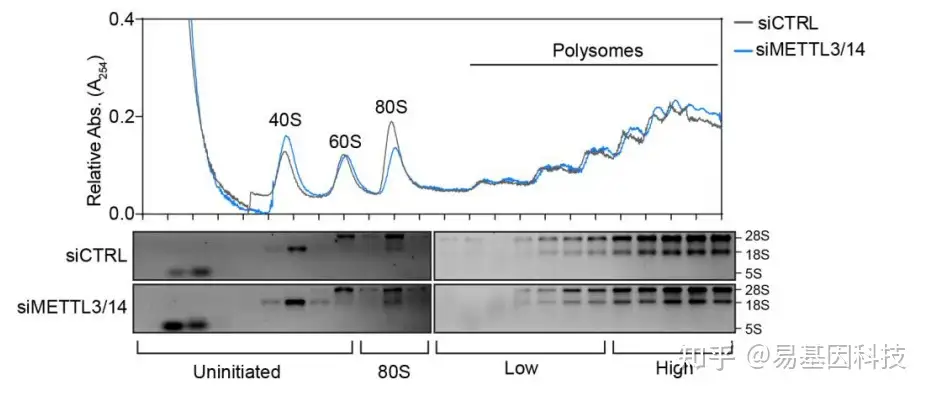
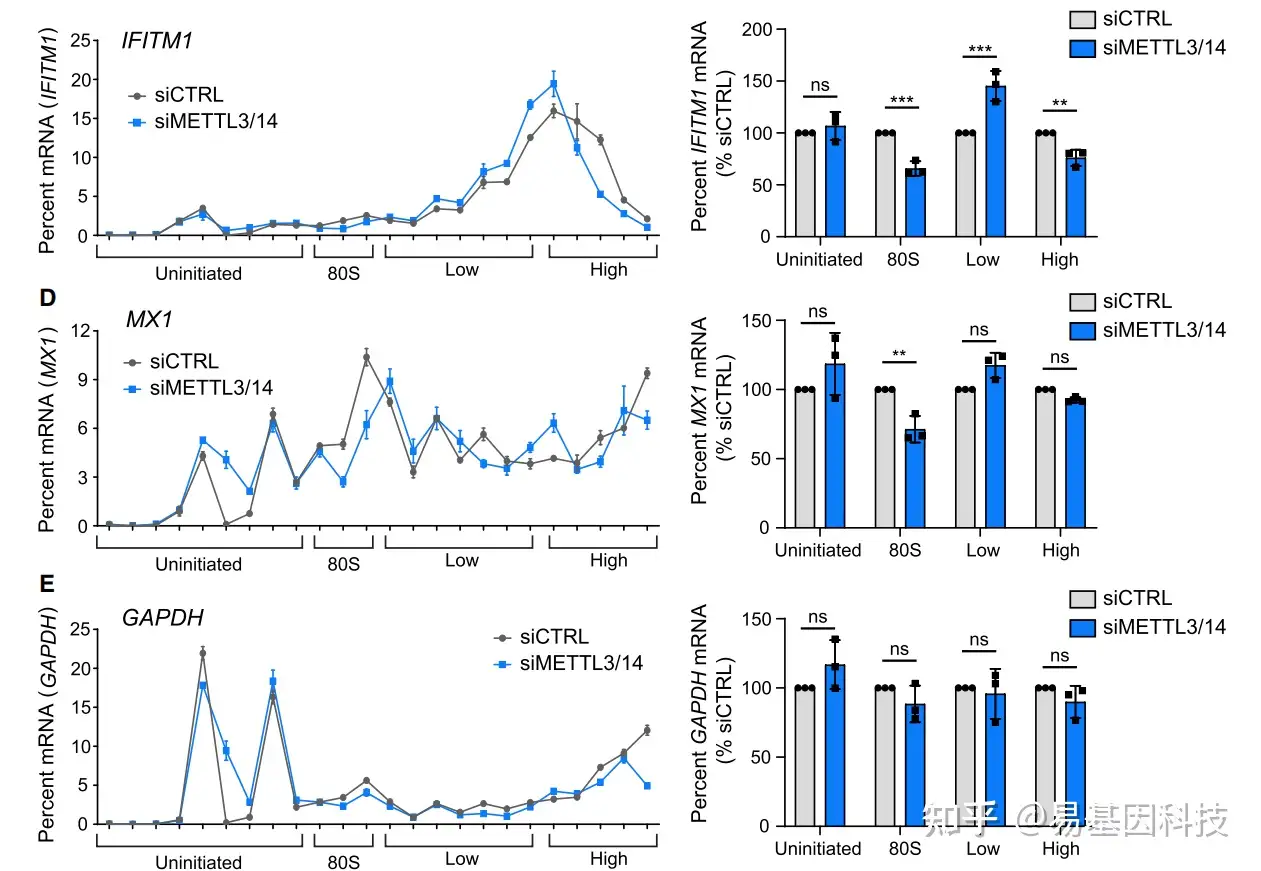
siMETTL3/14对目标基因与与核糖体的结合造成影响,对内参基因GAPDH无影响。
研究m6A是否通过调节mRNA的稳定性和降解而影响目标基因蛋白水平研究m6A对目标基因mRNA水平的影响RT-qPCRRNA-seq
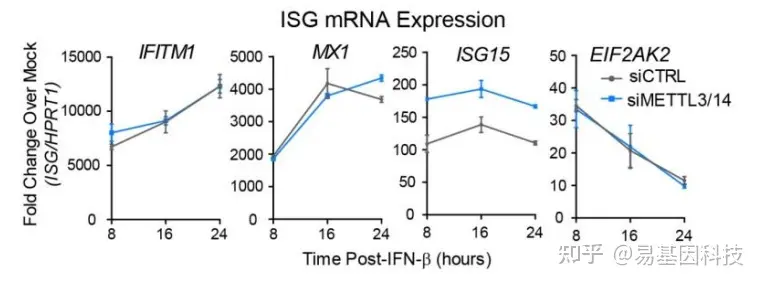
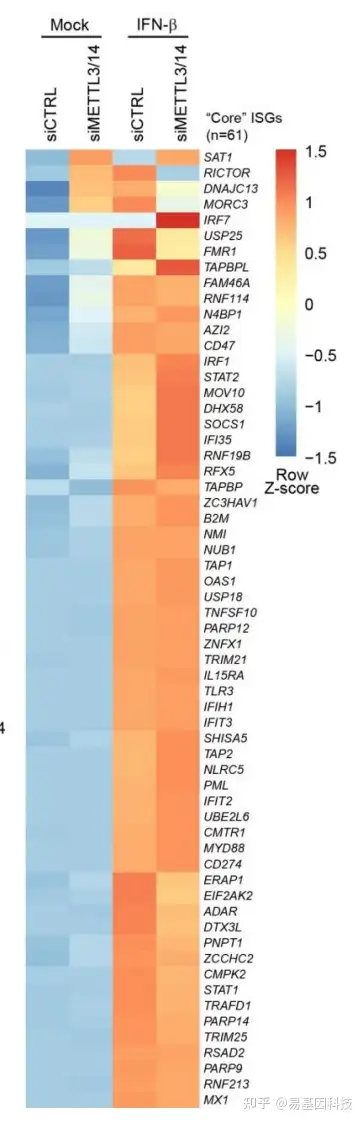
METTL3/14干扰后,采用RT-PCR和RNA-seq检测目标基因的mRNA水平是否收到影响
研究m6A是否通过调控RNA的出核(nuclear export)而影响目标基因蛋白水平
裂解细胞,超速离心分离细胞核与细胞质,然后分别进行RT-PCR实验检测细胞核与细胞质中的mRNA水平
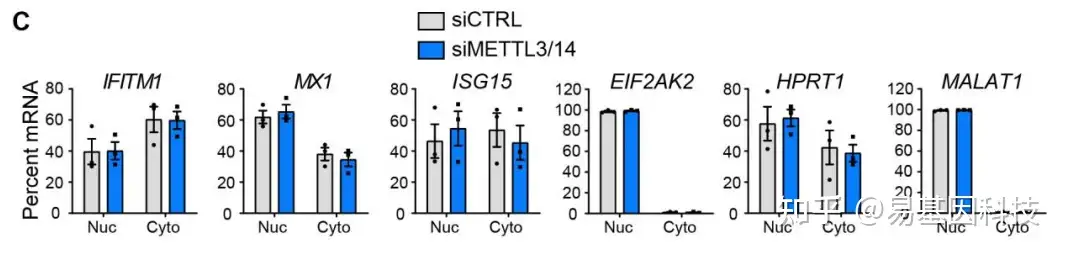
METTL3/14干扰后,采用RT-PCR检测目标基因在细胞核与细胞质中的mRNA水平是否受到影响
(5)m6A修饰目标基因的表达回复实验
writers的突变/敲降/敲除实验:RT-PCR检测目标基因的mRNA水平变化Western blot检测目标基因的蛋白水平变化检测目标基因的功能
writers的突变/敲降/敲除后,目标基因的过表达回复实验:
检测各项表型指数、细胞增殖、分化的回复情况
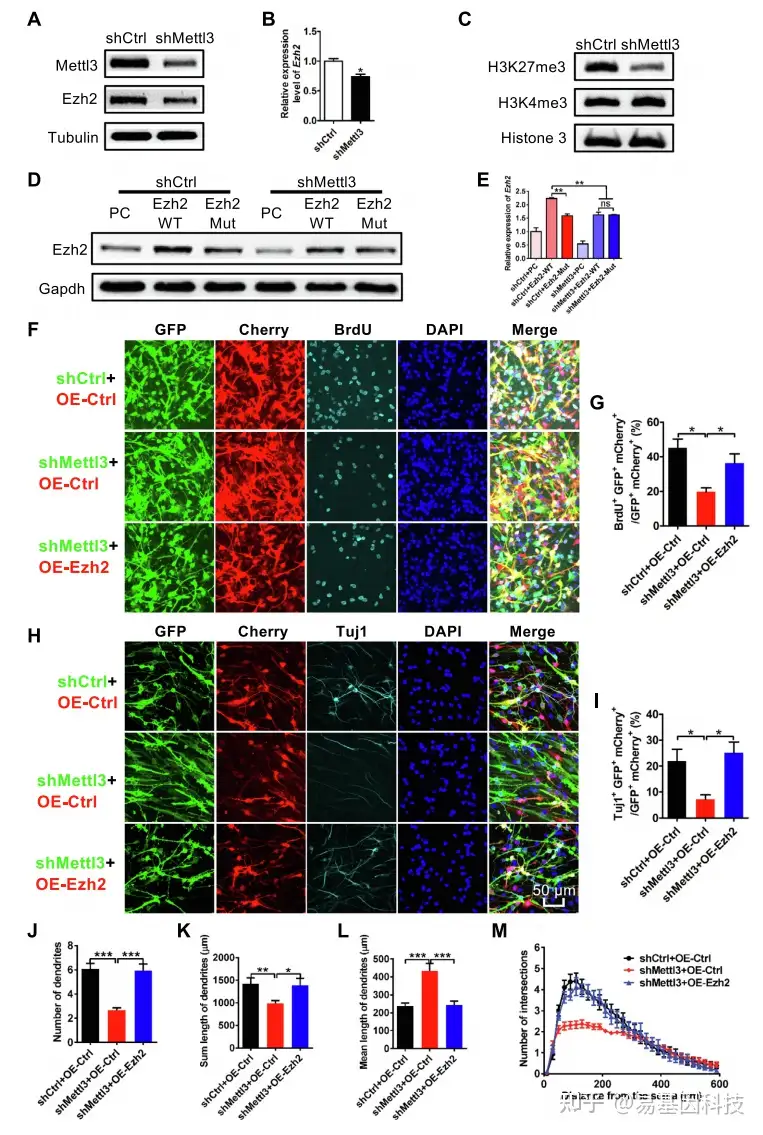
METTL3敲除后,靶基因Ezh2的蛋白表达受到影响。而靶基因Ezh2过表达回复实验会消除METTL3敲除对细胞增殖分化的不利影响
(6)研究特定m6A Readers通过结合目标基因RNA而影响目标基因的蛋白表达
合理推测结合目标基因的m6A Readers是哪一种
Readers的突变/敲降/敲除/过表达实验:
RT-PCR验证靶基因的mRNA水平
Western blot验证靶基因的蛋白水平
Readers的RIP-qPCR验证Readers蛋白与靶基因mRNA的结合
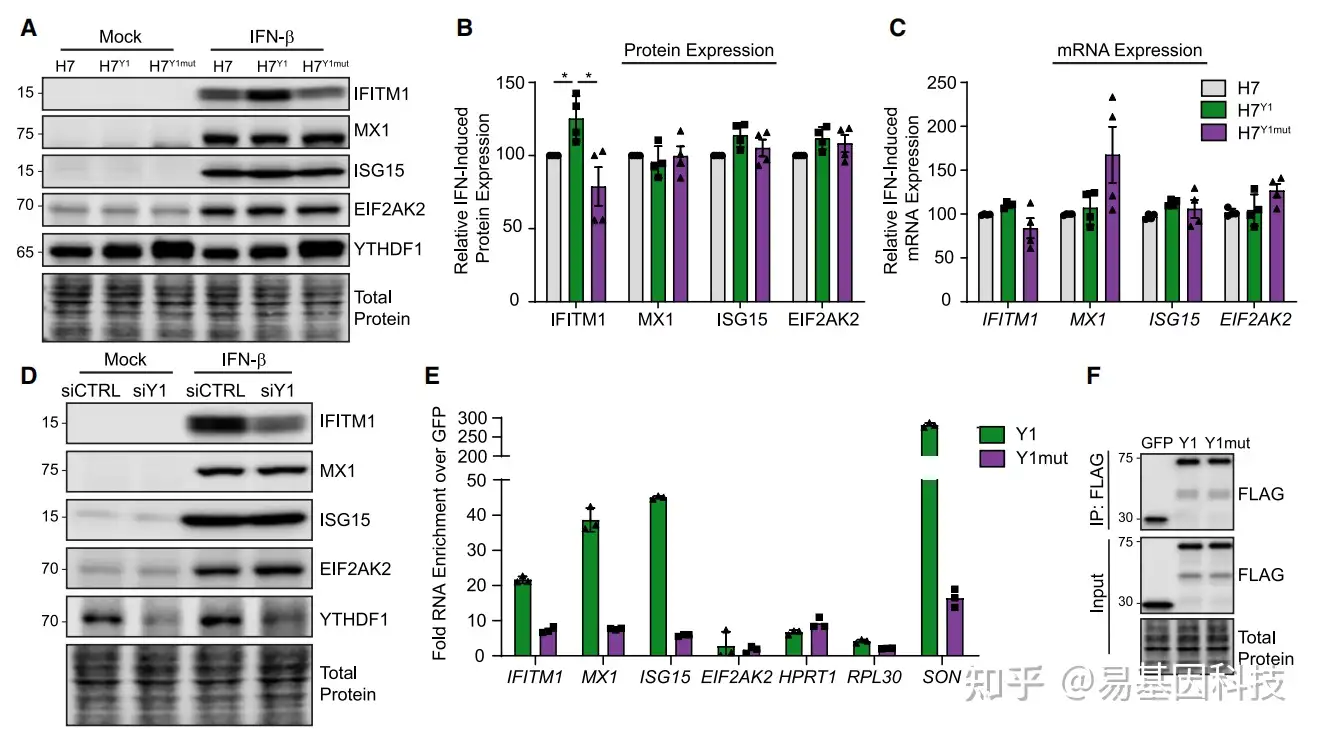
YTHDF1引入突变后,检测其假定靶基因的表达和与靶基因的结合是否受到影响
关于易基因RNA m6A甲基化测序(MeRIP-seq)技术
易基因MeRIP-seq技术利用m6A特异性抗体富集发生m6A修饰的RNA片段(包括mRNA、lncRNA等rRNA去除所有RNA),结合高通量测序,可以对RNA上的m6A修饰进行定位与定量,总RNA起始量可降低至10μg,最低仅需1μg总RNA。广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症发生与发展、药物应答等研究领域;可应用于动物、植物、细胞及组织的m6A检测。
大样本量m6A-QTL性状关联分析,传统MeRIP单个样品价格高,通常难以承担。易基因开发建立MeRIP-seq2技术,显著提成IP平行性,实现不同样本间相对定量,降低检测成本。
易基因提供适用于不同科研需求的MeRIP技术:
m6A甲基化-常量mRNA 甲基化测序(MeRIP-seq)
m6A甲基化-常量mRNA +lncRNA甲基化测序(lnc-MeRIP-seq)
m6A甲基化-微量mRNA +lncRNA甲基化测序(Micro-lnc-MeRIP-seq)
高通量m6A甲基化-常量mRNA甲基化测序(MeRIP-seq2)
技术优势:
起始量低:样本起始量可降低至10-20μg,最低仅需1μg总RNA;
转录组范围内:可以同时检测mRNA和lncRNA;
样本要求:可用于动物、植物、细胞及组织的m6A检测;
重复性高:IP富集重复性高,最大化降低抗体富集偏差;
应用范围广:广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症的发生与发展、药物应答等研究领域。
研究方向:
m6A甲基化目前主要运用在分子机制的理论性研究
疾病发生发展:肿瘤、代谢疾病(如肥胖/糖尿病)、神经和精神疾病(如阿尔兹海默症/抑郁症)、炎症…
发育和分化:早期胚胎发育、个体/组织/器官生长发育、干细胞分化与命运决定、衰老
环境暴露与响应:污染、抗逆、生活方式
领域:分子生物学
标签:高通量测序 实验验证方法