2024-1-18 11:10

作为微观世界探索者,色谱工作者有时候像一位运筹帷幄决胜于千里之外的战略家,有时候又像一位谋士,对微小的“变化”作出严谨缜密的判断。在方法开发过程中,pH就是分析胜败的关键因素,选择正确或优化的pH值往往是致胜关键一步。
无论反相、HILIC还是离子交换模式,样品和流动相的pH值对于您的分析获得理想结果至关重要。那么,你知道pH的概念是如何产生的吗?
pH

pH的概念是丹麦化学家S.P.L.索伦森在1909年提出的。
基本概念:pH是水溶性物质的酸度或碱度的量度。
更复杂的概念:液体中氢离子(H+)浓度相对于给定标准溶液的测量值。
更更复杂的概念:pH值是氢离子浓度(H+)的负对数,pH=-Log[H+]
现在,问题来了,pH中的“p”是什么?
无论何时,当你在pH值、pKa值、pKb值前看到一个“p”,这意味着你正在处理“p”后的数值的负对数。“p”的确切含义是有争议的,但根据索伦森1909年提出的,pH代表“氢的力量”。因此,“p”也可以代表“p”之后的值的幂。因此,pH由溶液中氢离子活性的负对数来定义。纯水的电导率较低,仅轻微电离,但是当水离解时,会形成:
H2O⇌H++OH–
其中,H+是氢离子的活性,OH–是氢氧根离子的活性。H+和OH-离子的浓度在25摄氏度时等于1×10-7离子/升。pH值刻度是由水的自动离解特性产生的。
pH=-Log[H+]/1x10-7lons/Liter
pOH=-Log[OH-]/1x10-7lons/Liter
[H+]+[OH-]=1x10-14
[-LogH+]+[-LogOH–]=14
“p”=-Log10
pH+pOH=14
上面的等式将pH标度设置为0-14,这给出了表示14个数量级的[H+]离子的方便方法。
电离度或离解度

要了解流动相中pH值的真正意义,首先我们需要了解酸性或碱性化合物的电离度或离解度。化合物的pH值可以表明你处理的是酸还是碱,但它提供的指示酸或碱的真实强度的信息有限,这就是电离或离解度概念的来源。

pKa=[-LogKa]
pKb=[-LogKb]
Ka=酸离解常数或[H+]离子浓度
Kb=碱离解常数或[OH–]离子浓度
大多数弱酸的Ka在10-2到10-14之间,因此,大多数弱酸的pKa在2-14之间。
酸越强,它的pKa值越小,碱越强,它的pKb值越大。接下来,我们将主要使用术语“pKa”来解释这个概念。
所有可以被反相色谱分析的分析物都会发生轻微电离,因此,它们可以是“弱酸”或“弱碱”。因此,在处理这类极性化合物(弱酸或弱碱)时,您应该始终了解化合物的pKa或pKb值,因为这将有助于您确定流动相的正确pH值。
在反相色谱中,为了实现分析物的分离和良好的峰形,疏水和一些离子相互作用在固定相和分析物之间的选择性中起主要作用。为了实现这一目标,化学家的主要目标应该是得到处于单一状态、去质子或未电离状态的所需分析物。分析物的电离状态直接影响分析物与固定相的相互作用程度。
当一个分子被电离时,它的极性更大,因此更有可能参与氢键。与中性分子相比,在具有水性流动相的反相中,分析物将花费更少的时间与固定相发生疏水相互作用,而花费更多的时间与流动相的水性部分形成氢键,结果是极性分子的保留更少。

当分析物的电离形式和中性形式的浓度都很高时,电离形式的疏水性相互作用较小,而中性形式的疏水性相互作用较大,结果会出现宽且不对称的峰。
硅胶中存在的少量游离硅烷醇基团或金属污染物可能会与分析物的离子化状态发生离子相互作用,从而导致峰形不佳或不可重现。
现在,通过了解分析物的pKa值,可以预测分析物相对于流动相pH值的电离状态,换句话说,我们可以通过简单地调节流动相pH值来控制分析物的电离状态。

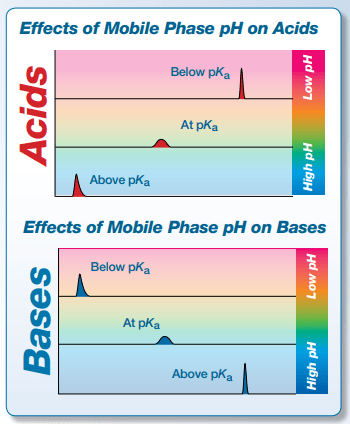
因此,对于酸:
when pH=pKa-2 | The acid is 1% dissociated (mostly deprotonated). |
When pH=pKa | The acid is 50% dissociated (equal amounts of ionized and unionized). |
When pH=pKa+2 | The acid is 99% dissociated (mostly ionized). |
对于碱:
When pH=pKa-2 | The base is 99% dissociated (mostly ionized). |
When pH=pKa | The base is 50% dissociated (egual amounts of ionized and unionized). |
When pH=pKa+2 | The base is 1% dissociated (mostly deprotonated). |
上表中的值可为根据分析物的pKa值决定流动相的pH值提供指导。为了最大限度地中和分析物,流动相的pH值必须比pKa值高或低至少2个单位。

由于液相色谱处理部分或完全极性的化合物,液相色谱面临的两个主要挑战是酸性化合物的保留和碱性化合物的峰形,幸运的是,这两个问题都可以通过选择和控制适合您的样品和流动相的最佳pH值来解决。下图恰当地展示了选择与酸性和碱性化合物的保留时间和峰形相关的正确流动相pH值的好处。
点击图片获取
电子版pH方法开发海报,
前50名更有纸版相送
领域:结构生物学