2024-5-08 17:16
G蛋白偶联受体(GPCR)参与许多细胞信号转导通路。目前,超过45%的药物都以GPCR为靶点。确定GPCR细胞活性,可以通过监测细胞内Ca2+浓度的变化来实现。Ca2+直接或间接调节包括基因表达、细胞运动和收缩在内的许多生理过程。诸如蛋白激酶C(PKC)、转录因子NFAT或钙调磷酸酶等多种蛋白质均受Ca2+浓度变化的调节。在此,我们介绍了使用VICTOR™ Nivo多模式读板仪以水母发光蛋白生物发光检测方法,分析在GPCR刺激或抑制下的快速胞内Ca2+信号。
化学发光法检测原理是基于GPCR的激活引起细胞质Ca2+浓度增加:当GPCR被激动剂激活后,Gαq亚基从G蛋白解离并诱导肌醇三磷酸浓度增加;从而引起钙从内质网流入。该检测采用稳定表达人组胺H1 GPCR和水母发光蛋白的CHO细胞系进行。已知的激动剂和拮抗剂用于受体刺激。检测中,细胞与腔肠素-h一起孵育。腔肠素-h穿透细胞膜并在氧气存在下与高表达的水母发光蛋白结合,导致后者重组。在三个Ca2+离子的作用下,水母发光蛋白分子将腔肠素-h底物氧化为腔肠酰胺,释放二氧化碳并在469nm处产生具有峰值的闪光,通过VICTOR Nivo检测。
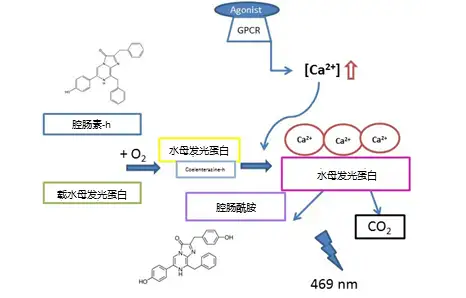
由于GPCR激活后细胞内Ca2+浓度增加且相应的闪光产生速度非常快,因此该检测需要极快速的测量响应。VICTOR Nivo读板仪的分液器可以满足这一需求,它可以在进样后0.1秒从微孔板底部检测发光信号。
结果与讨论
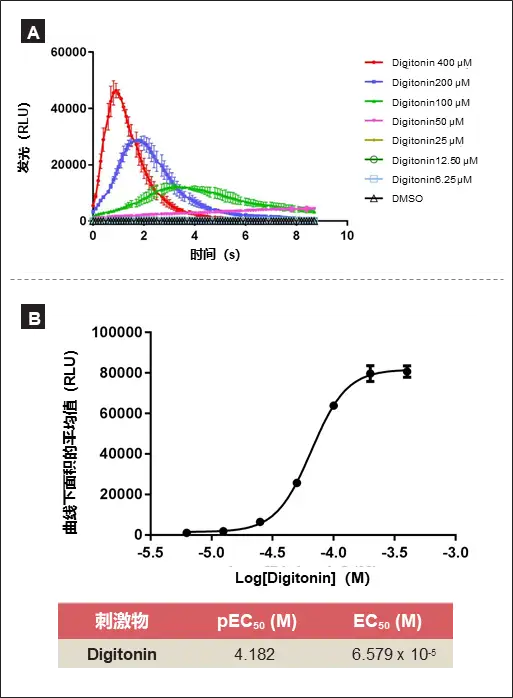
阳性化合物Digitonin量效关系
VICTOR Nivo系统的动力学检测模式在添加阳性对照Digitonin后精确测量随时间变化的发光信号(图2)。结果表明,Digitonin浓度越低,产生光信号延迟越长,而最高浓度的Digitonin能最快产生光信号。这显示了化合物浓度对Ca2+和信号产生所需时间的影响VICTOR Nivo对发光信号曲线的快速动力学测量提高了在不同化合物浓度下化合物效应检测的准确性,因此能够精确计算剂量反应曲线。对Digitonin动力学测量中产生的信号进行整合,并计算曲线下面积的平均值,以生成剂量-反应曲线。这证实Digitonin能作为水母发光蛋白检测中的对照品。
细胞数滴定
为了确定H1/水母发光蛋白细胞的检测窗口,进行了细胞数滴定。不同数量的细胞产生的发光信号正相关不同的Ca2+浓度。Histamine作为H1受体的标准激动剂。结果表明,当细胞数约80000-100000个/孔时,发光信号达到饱和。此外,在不同细胞密度下,光信号的峰值都是同时产生的。因此,以20000个细胞/孔进行后续实验。
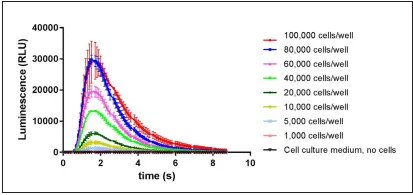
在每孔不同数量的细胞中加入组胺(1.56μM)产生的发光信号。
使用组胺优化激动剂信号检测
使用优化的细胞数,在H1受体受到组胺刺激后记录激动剂检测的动力学测量结果。
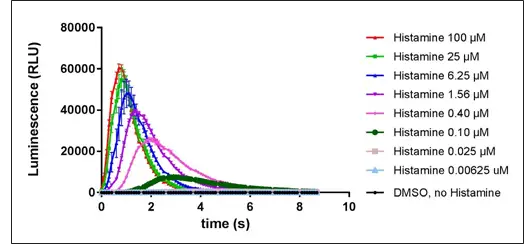
使用20000个细胞/孔,在H1受体受到组胺刺激后产生的Ca2+信号反应的动力学。
与Digitonin类似,研究表明,组胺浓度越低,产生闪光越滞后,而最高浓度的组胺会立即引发光信号。对H1 GPCR动力学测量中产生的信号进行整合,并绘制曲线下面积的平均值,以生成剂量-反应曲线。计算得出384孔板实验条件下组胺的EC50为143.4nM。与先前发表的数据一致。
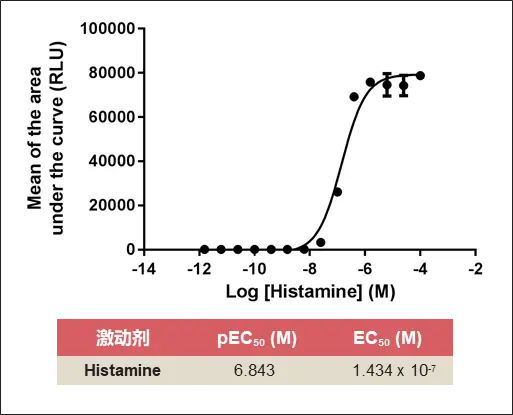
通过在96孔板格式中重复该实验,证实了该方法的普适性。108nM组胺的EC50与384孔板实验中计算的143nM EC50在同一范围内,表明该方法适用于不同类型的微孔板。
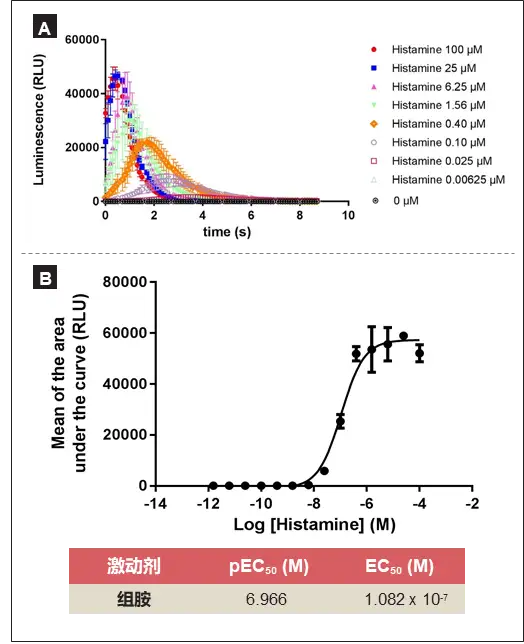
96孔板格式中H1受体刺激后的激动剂检测。A:在H1受体受到组胺刺激后产生的Ca2+信号反应的动力学。B:组胺激动剂刺激H1受体后的剂量-反应曲线。
抑制剂信号检测
为了证明H1-水母发光蛋白检测法也可用于受体抑制剂检测,在激动剂检测实验中测定的EC80浓度下,用Triprolidine(曲普利啶)对组胺进行了拮抗剂检测。绘制曲线下面积的平均值,以生成剂量-反应曲线,计算Triprolidine的IC50为12.28nM。
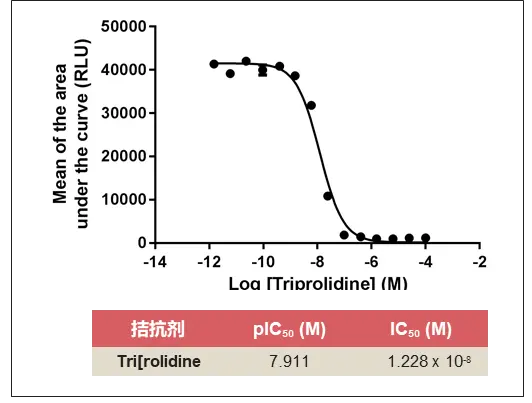
EC80浓度下通过曲普利啶拮抗剂对组胺激动剂进行检测的H1受体抑制的剂量-反应曲线。
结论
本研究描述了水母发光蛋白快速发光检测法的优化,以检测激动剂和拮抗剂对Ca2+偶联的组胺H1 GPCR的影响。该方法的标准偏差低,板间差异性小,再现性良好。VICTOR Nivo多模式读板仪与分液器结合非常适用于这类检测。使用预先设定的方案,利用孔内信号发生动力学测量和板底部快速信号检测,结合VICTOR Niv的分液器,为该检测提供了灵活性。
参考文献
1. J. A. Salon, D. T. Lodowski and K. Palczewski, The significance of G-Protein Coupled Receptor Crystallography for Drug Discovery, ASPET Pharmacological Reviews (2011).
2. Berridge M.J., Lipp P., Bootman M.D. The versatility and universality of calcium signalling. Nat Rev Mol Cell Biol. (2000).
3. Iversen P. W., Eastwood B. J., Saittampalam G. S., Cox K. A Comparison of Assay. Performance Measures in Screening Assays: Signal Window, Z´ Factor, and Assay Variability. Ratio. Biomolecular Screening (2006).
4. Oksa V. V., Kivela P., Aequorin Bioluminescence assays on MicroBeta2 LumiJet for studying Ca2+-coupled GPCRs and ion channels. Application Note, PerkinElmer (2009).
5. Technical Data sheet: human Histamine H1 Receptor Aequorin Cell Line, PerkinElmer.
领域:细胞生物学