2024-5-10 16:38
高浓度的IL-2是提高TME浸润、逆转肿瘤免疫抑制的重要炎症细胞因子。如何在保证IL-2起效的同时降低IL-2的全身毒性是众多实体瘤免疫疗法开发的重要研究方向。
2022年12月加州大学旧金山分校的研究团队在Science上展示了他们的方案。该临床前试验选择通过在T细胞上搭载合成细胞因子的通路,在体内驱动,使细胞自主产生IL-2,尽可能使IL-2仅在目标肿瘤TME中产生作用,降低全身毒性。
局部合成IL-2的机制与效果
为了让IL-2不在全身扩散,自主合成细胞因子回路需要在肿瘤TME的免疫抑制环境中依然能够被活化。抑制性肿瘤微环境既可以减少IL-2的产生,也可以竞争性地消耗IL-2。因此,这种回路需要独立于TCR/CAR激活。
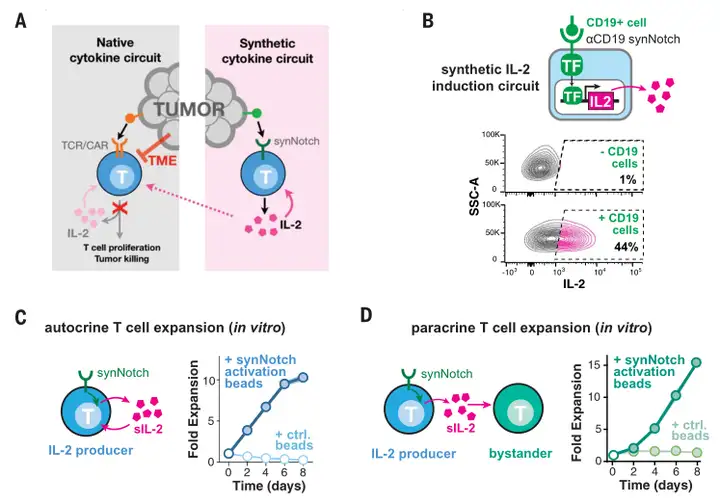
Science. 2022 Dec 16;378(6625):eaba1624.
该研究团队采用抗CD19的合成Notch受体(synNotch)来诱导IL-2转基因的转录。该受体正是2016年由该实验室开发的。
SynNotch受体能够使用细胞外识别域来识别靶抗原。与CAR不同,这种靶抗原的结合不会触发T细胞活化。相反,抗原结合诱导膜内受体切割,释放转录结构域进入细胞核,促进目标转基因的表达。
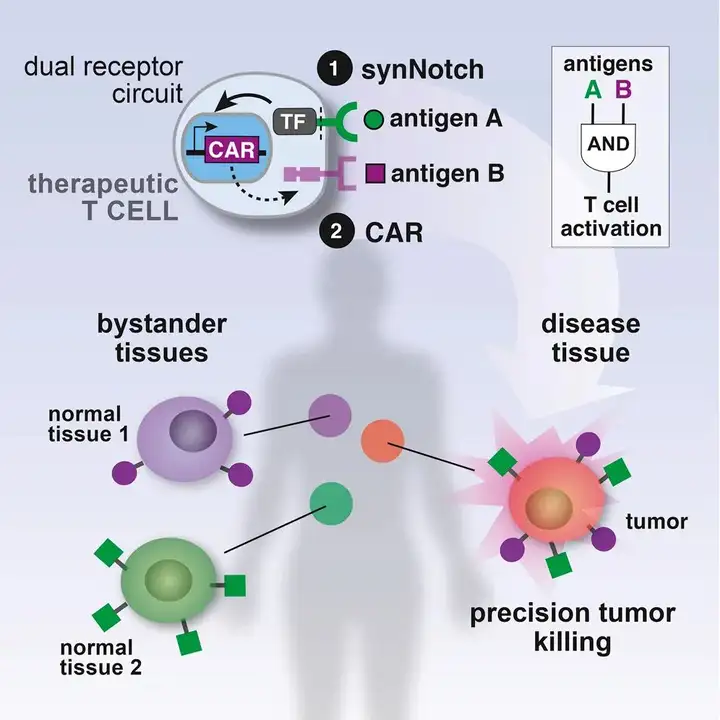
Cell. 2016 Feb 11;164(4):770-9.
旁分泌:
SynNotch→IL-2回路能够通过旁分泌方式,与T细胞杀伤协同驱动局部T细胞增殖。
体外模型显示,刺激synNotch受体能诱导工程T细胞群的强烈增殖。同时也能驱动共同培养的非工程T细胞和NK细胞进行增殖。
免疫分析显示,CAR - T细胞仅在肿瘤内扩增,激活标记物增加,衰竭标记物减少。合成IL-2的产生可能使浸润的T细胞存活并启动持续的car介导的激活、扩增和肿瘤杀伤。
其增殖程度取决于γ-细胞因子负载的类型。
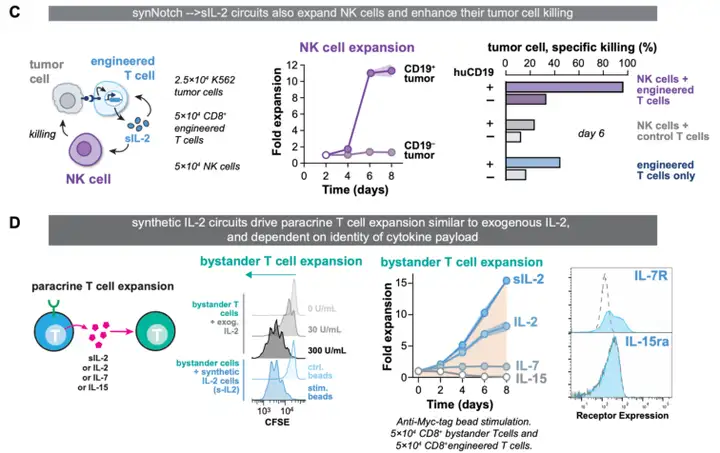
Science. 2022 Dec 16;378(6625):eaba1624.
自分泌:
在多种免疫抑制的肿瘤模型中,合成IL-2回路能通过自分泌方式显著增强T细胞的细胞靶向毒性,并提高其浸润性。
通过这种回路,免疫疗法中的治疗性T细胞可视为一种新型逻辑门T细胞(“与”门),在触发其完整的细胞毒性反应之前需要两种抗原:T细胞激活所需的TCR抗原和诱导IL-2产生所需的synNotch抗原,从而表现出增强的特异性。
NY-ESO-1+黑素瘤双侧肿瘤模型中:
缺乏合成IL-2电路的抗NY-ESO-1 TCR+ T细胞在控制单(NY-ESO+)和双(NY-ESO+/GFP+)抗原肿瘤的生长方面基本无效;
用同时表达反NY-ESO-1 TCR和抗GFP synNotch→sIL-2电路的T细胞治疗小鼠时,双靶点NY-ESO+/GFP+肿瘤则显著减小。
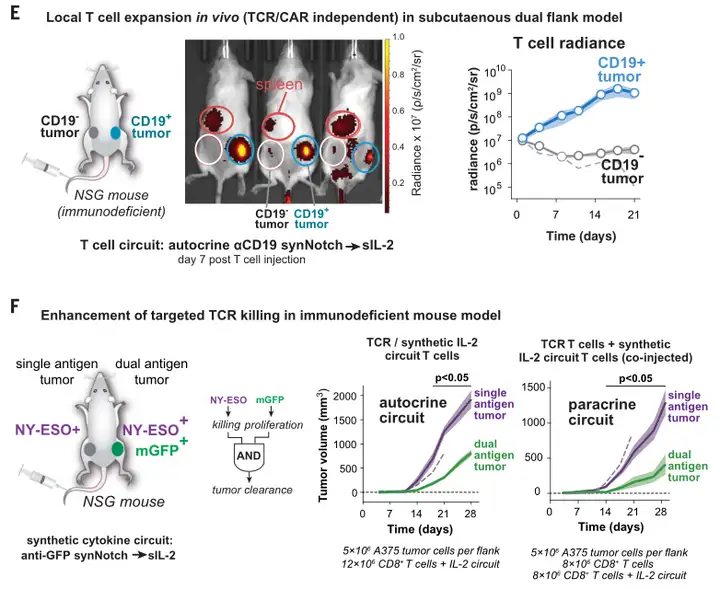
Science. 2022 Dec 16;378(6625):eaba1624.
T细胞仅在合成IL-2通路靶向的肿瘤中发生瘤内扩增;
合成的IL-2电路仅在靶向的双抗原阳性肿瘤中被激活;
在该靶向肿瘤中T细胞激活标志物显著增加。
但同时,合成的IL-2回路T细胞没有同时传递肿瘤反应性细胞毒性T细胞群,不能产生肿瘤控制。
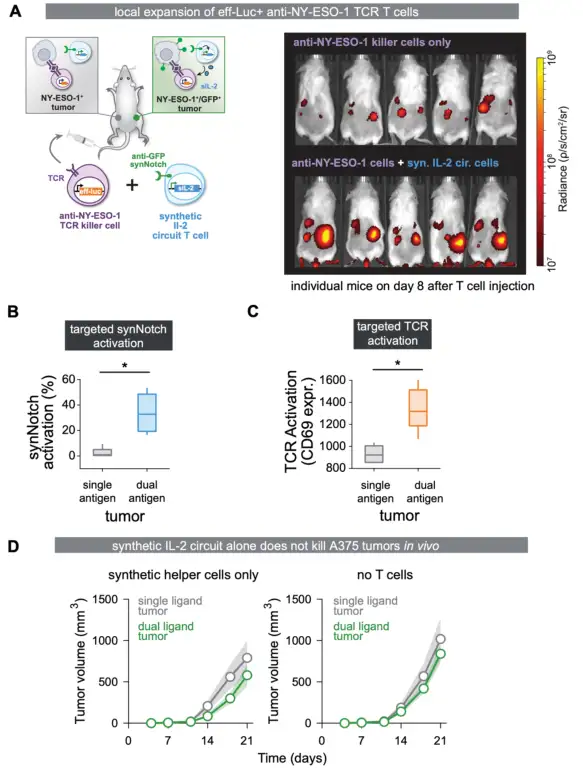
Science. 2022 Dec 16;378(6625):eaba1624.
抗间皮素CAR-T细胞治疗的肿瘤中:肿瘤核心内的T细胞浸润非常有限,大多数T细胞聚集在肿瘤周围。相比之下,用含有合成自分泌IL-2电路的CAR - T细胞治疗的肿瘤显示整个肿瘤核心的T细胞浸润显著增加。
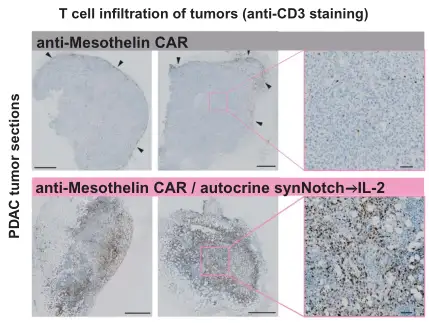
Science. 2022 Dec 16;378(6625):eaba1624.
在免疫正常的小鼠模型中,旁分泌IL-2回路不再具有肿瘤杀伤能力。只有通过合成IL-2回路的自分泌通路,才能观察到CAR-T细胞介导的肿瘤改善,即细胞毒性受体(CAR)和synNotch→IL-2回路必须在同一个细胞内共同表达。
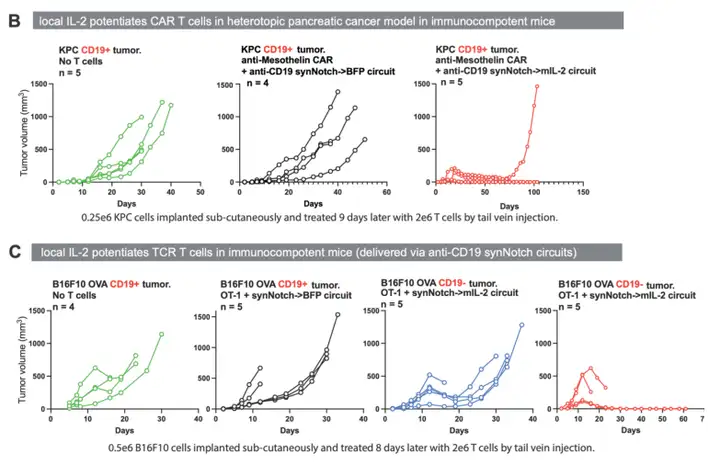
Science. 2022 Dec 16;378(6625):eaba1624.
其原因可能是在免疫正常模型中存在与细胞毒性T细胞存在竞争的IL-2消耗细胞(例如旁观T细胞和Treg细胞),从而导致了自分泌和旁分泌回路之间的主要差异,使旁分泌回路可能对这种IL-2消耗性细胞更敏感。
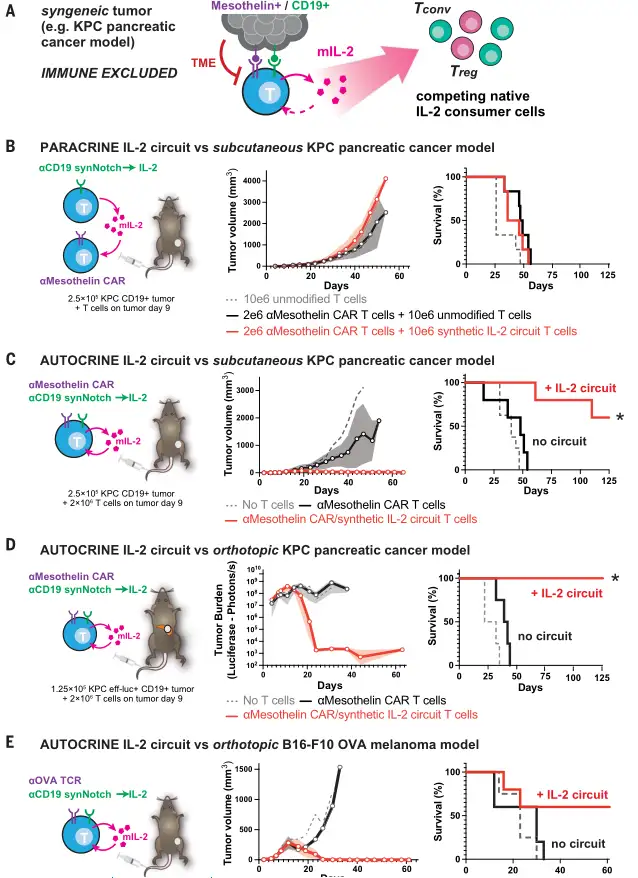
Science. 2022 Dec 16;378(6625):eaba1624.
小结
这种利用细胞因子自主合成回路的方式在临床前模型中的确能够在显著降低全身毒性的情况下促进CAR-T对免疫抑制性实体瘤的浸润和杀伤。
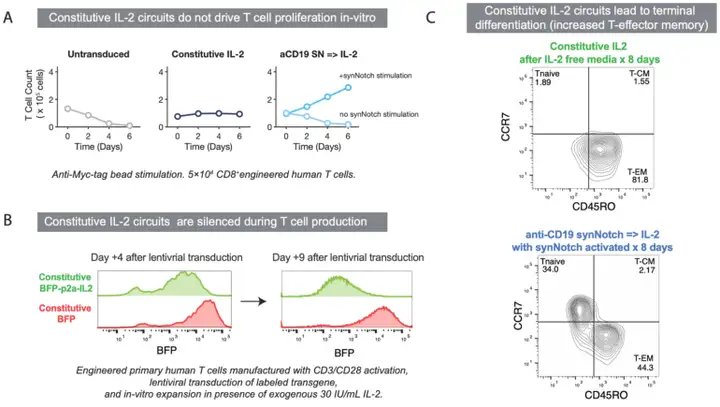
IL-2产生的时间和方式对其在实体瘤中的作用结果至关重要。人体本身分泌的构成性(constitutive)IL-2的量不足以支持体外T细胞增殖。
同时,IL-2对T细胞活性具有双重作用。IL-2会促进活化诱导的细胞死亡,同时也影响T细胞分化。这种负面影响会因构成性IL-2的产生而加剧。诱导性(inducible)IL-2则可相对避免此影响。
Science. 2022 Dec 16;378(6625):eaba1624.
研究人员也观察到幼稚T细胞同样在这种方式中进行增殖,也意味着肿瘤中的宿主常规T细胞也可以大量消耗IL-2。因此,如果下一步能够顺利进入临床,诱导性IL-2的抑瘤效果是否能够抵消人体内其他多种非杀伤性T细胞的消耗,将成为其成药价值的重点。
参考文献:
1.Allen GM, Frankel NW. Synthetic cytokine circuits that drive T cells into immune-excluded tumors. Science. 2022 Dec 16;378(6625):eaba1624. doi: 10.1126/science.aba1624. Epub 2022 Dec 16. PMID: 36520915.
2.Roybal KT, Rupp LJ, Morsut L, Walker WJ, McNally KA, Park JS, Lim WA. Precision Tumor Recognition by T Cells With Combinatorial Antigen-Sensing Circuits. Cell. 2016 Feb 11;164(4):770-9. doi: 10.1016/j.cell.2016.01.011. Epub 2016 Jan 28. PMID: 26830879; PMCID: PMC4752902.
领域:细胞生物学