2024-5-16 14:23
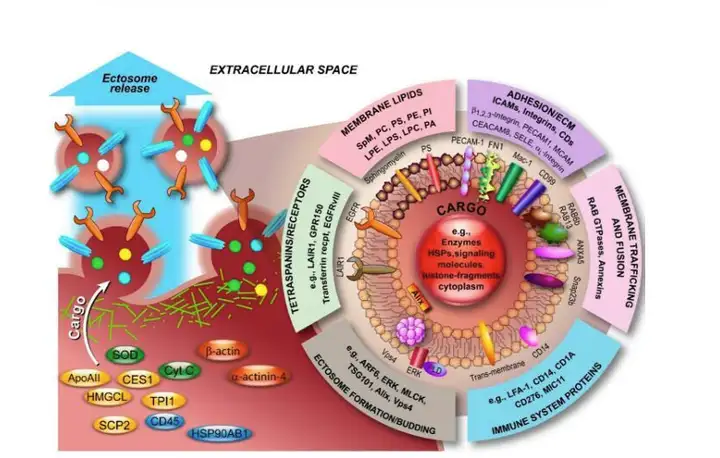
Exosome (外泌体) 1983 年首次于绵羊网织红细胞中被发现,是活细胞分泌的直径约为 30-150nm 的膜性囊泡,包含多种活性分子,如蛋白质、脂肪和核酸(mRNA、miRNA及其 它非编码RNA)等,能作为信号分子传递给靶细胞,从而介导细胞间的物质传递与信息交 流。天然存在于体液中,包括血液、唾液、尿液和母乳等。外泌体 miRNA 通过循环囊泡 传递信息,被认为是细胞间信号交流的第三种途径。除了 miRNA 外,研究表明外泌体中 的 circRNA、lncRNA和蛋白质也参与细胞内的信号调控。2013年,发现细胞囊泡运输的调 节机制的科学家们,荣获了当年诺贝尔生理学或医学奖。作为人体内的一类重要囊泡,外泌 体成为科研热点。
外泌体结构能够保护活体性物质远距离不被降解,通过配体和细胞表面受体高效结合, 进行信息的传递。但是外泌体一把双刃剑,既参与正常的生理发育调节过程,又参与病理过 程。改变细胞外微环境、提呈抗原、刺激T细胞增殖、诱导机体免疫反应及影响机体健康。 如树突状细胞,分泌的外泌体有抗原递呈的作用,能够激活T细胞;曹雪涛院士课题组证 实,肿瘤外泌体RNAs通过激活肺泡上皮TLR3招募中性粒细胞促进了肺转移前微环境形成。
目前对于外泌体的研究,主要集中在外泌体在生理和病理条件下发挥作用的机制;外泌 体作为液体活检技术在癌症的临床诊断、预后判断中的应用;外泌体在疾病治疗方面的应用 是,从治疗剂的包装到调控免疫应答,应用范围从肿瘤学到再生医学等。利用小动物活体成 像技术,可在活体水平长期观察外泌体的分布、靶向以及判断外泌体对于疾病的治疗。应用 上述多种研究领域。
一.功能相关研究
1.与肿瘤转移相关研究
癌症是由多种细胞、因子共同作用产生的,它存在于一个复杂的细胞生态系统中,即肿瘤微 环境。在肿瘤转移过程中,微环境对于转移的肿瘤细胞的存活与增殖都是必需的。已有研究 表明肿瘤细胞的转移具有器官特异性,说明特定的器官可能具有更适合肿瘤细胞转移的环境。 研究肿瘤的分子环境有助于找出一些可以阻止肿瘤细胞转移的新靶点。越来越多的研究表明 外泌体参与了肿瘤发生、生长、侵袭和转移的过程。
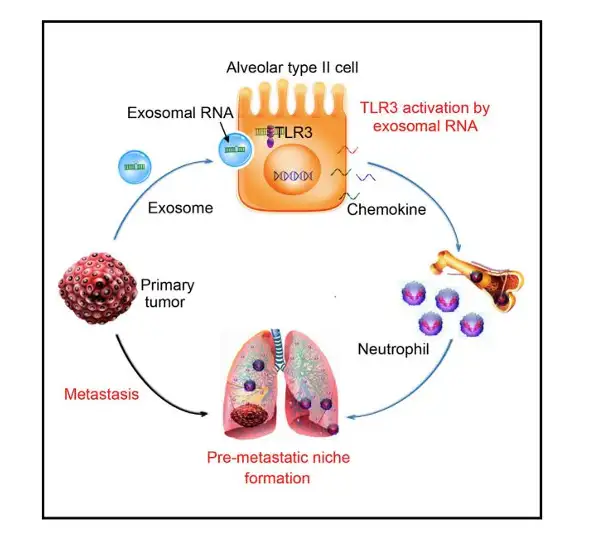
曹雪涛院士课题组证实,肿瘤外泌体RNAs通过激活肺泡上皮TLR3招募中性粒细胞促进 了肺转移前微环境形成。这一研究发现发布在 Cancer Cell(Cancer Cell 30, 243–256, August 8, 2016)杂志上。研究表明肺上皮细胞通过TLR3感知肿瘤外泌体RNAs,对于启动 中性粒细胞招募及肺转移微环境形成起至关重要的作用,为控制癌症肺转移提供了潜在的靶 点。在自发性转移模型中TLR3缺陷小鼠显示肺转移减少。机制研究证实,原发肿瘤来源的 外泌体RNAs富含小核RNA(small nuclear RNAs,snRNAs),在肺上皮细胞中激活TLR3,由 此诱导了肺脏中的趋化因子分泌,促进了中性粒细胞招募。在研究中使用荧光素酶基因标记 LLC 和 B16/F10,通过尾静脉注射的方式注射 Tlr3/ mice和野生型C57BL/6小鼠,通过IVIS 小动物活体成像系统对肺部进行成像和定量(下图 B),结果显示,Tlr3/ 小鼠肺部的转移 明显低于野生型小鼠;同时进行肺部切片进行H&E染色,使用Revvity公司组织定量病 理系统进行成像和精确的定量,计算肺部肿瘤的转移负荷(下图A)
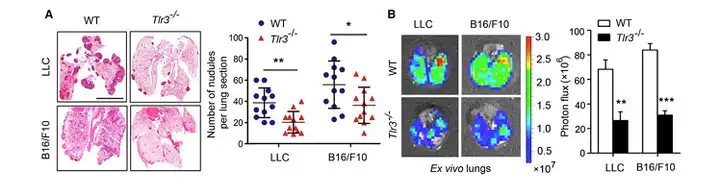
上图.TLR3 Deficiency Prevents Lung Pre-metastatic Niche Formation
此外在研究中,还考察了外泌体的分布及外泌体注射后能够在肺部形成一个促进肿瘤的 转移的微环境提高肿瘤的转移率。首先在考察外泌体分布时,体外采用鼠Lewis细胞株(LLC)产生的瘤块,瘤块切割成小块后在武血清培养基中进行培养12 hr,随后收集培养基过滤后通 过超离的方式进行提取,提取的外泌体使用VivoTrack 680进行标记,尾静脉注射后不同时 间点进行成像,结果显示外泌体通过尾静脉注射后会被肺部摄取(下图),其他证据显示主 要是被肺泡 II 型上皮细胞摄取。在 Tlr3-/-和野生型小鼠首先通过外泌体或者对照脂质体的 预处理,两周后,注射LLC-luc细胞株,外泌体注射30天时利用IVIS系统进行生物发光成 像(处理过程如D所示),检测肿瘤的转移并且进行定量(下图J),结果显示,预先注射分离 自肿瘤的外泌体,能够增加野生型小鼠肺部肿瘤的转移,而Tlr3-/-小鼠则与对照物差异,说 明外泌体能够产生肿瘤转移的微环境,促进肿瘤的转移,而这种效应是通过肺上皮细胞Tlr3 介导的。
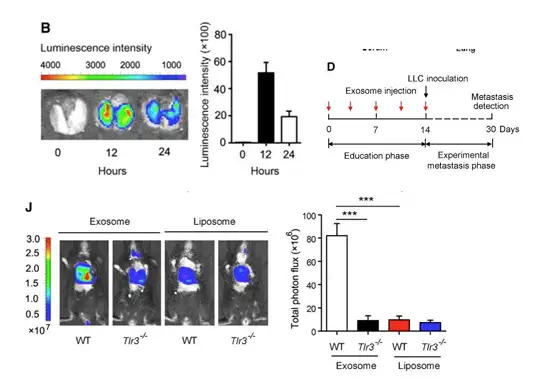
上图.评价外泌体的激活肺上皮细胞的TLR3诱导细胞因子的产生和中性粒细胞的招募
Cancer Cell,2016 ,30,(2) 8 : 243-256
2.外泌体与免疫相关研究
复旦大学研究人员 Gao Wei 利用 IVIS 成像系统研究了树突状细胞来源的外泌体 (DC-exos)在体内的归巢和功能。成熟树突状细胞通过趋化因子7(CCR7)向次级淋巴器 官的归巢。据报道来源于DCs的外泌体会迁移到脾脏诱导炎症的发生。在活体成像实验中, 首先从成熟和未成熟的树突状细胞培养液中分离外泌体,使用近红外染料 DiR 进行染色, 随后通过尾静脉注射的方式将20μg外泌体注射入C57BL/6体内,使用IVIS进行活体成像(下 图A),并且注射4个小时后,将动物解剖,将肝脏和脾脏解剖后进行成像(下图B),结果显 示注射的外泌体主要集中在动物的上腹部,离体结果显示相对与 DC-exos 未成熟成熟的 DC-exos 更多的积累在脾脏。
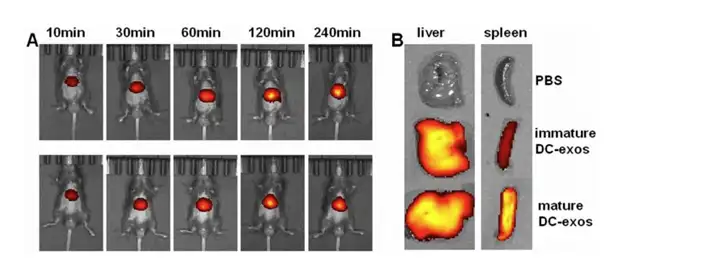
上图. DC-exos 体内分布研究
进一步研究确认成熟 DC-exos 在脾脏累积受 CCR7 调控,mDCs 转染 siRNA CCR7,进行 CCR7的沉默,结果显示在CCR7沉默后,成熟DC-exos在脾脏的累积减少。说明了DC-exos 在脾脏累积受CCR7调控。活体中这些脾脏的DC-exos 被脾脏的DCs 和T cells 摄取诱导 炎症反应。这些数据提供了一个新的视野去理解外泌体,外泌体会从亲代细胞中获取某些特 定的功能。
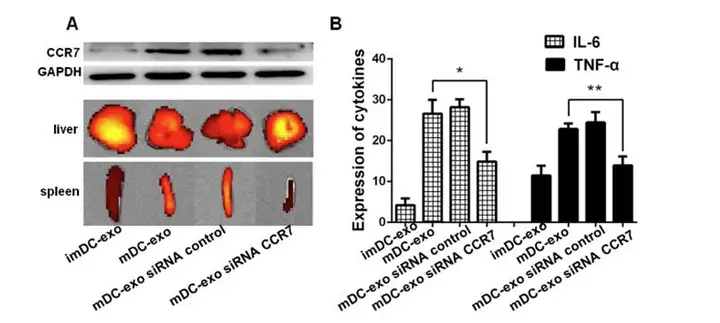
上图.CCR7调控成熟DC-exos在脾脏的累积,体内诱导炎症反应。
Scientific Reports , 2017 , 7 :42996
二.外泌体分布研究
Oscar P. B. Wiklander 研究了不同来源的外泌体注射体内后其分布规律。首先探讨了 HEK293T 细胞来源的外泌体(HEK293T-EVs)在 NMRI小鼠体内的分布,即使用1.0×1010 p/g 近红外荧光染料DiR标记HEK293T-EVs,通过尾静脉注射NMRI小鼠体内,注射24h后使 用 IVIS 小动物活体成像系统进行成像(图 A),并且使用 IVIS 系统进行三维光学成像, Quantum microCT 系统进行结构成像,最后将两者图像进行融合(图B)。从活体数据可以看 出HEK293T-EVs主要集中在动物的肝脏。为了确认荧光信号确实来自标记的HEK293T-EVs, NMRI小鼠尾静脉注射HEK293T-EVs (1.0×1010 p/g)或者游离OptiMEM-DiR,24h后将PBS未灌注和灌注的HEK293T-EVs注射组脏器及OptiMEM-DiR注射组脏器去除进行定量(图 C),结果可以看出,首先Dir已经检测不到信号,而灌注和未灌注组,荧光信号无显著差异, 说明信号检测到的信号是来自于器官中HEK293T-EVs的信号,而不是游离染料或者血液中 的信号。为了进一步确定剂量是否影响EVs的分布,NMRI小鼠尾静脉注射HEK293T-EVs (0.25×1010 p/g、1.0×1010 p/g、1.5×1010 p/g),24h 将脏器进行解剖进行离体成像,并且计 算各组织荧光信号站总信号的百分比(图D/E),结果显示,不同注射剂量,EVs分布主要 集中在肝脏、脾脏、肠道等部位,但是随着剂量的增加,整体信号增加,但是肝脏信号的百 分比会降低,提示这一变化可能跟肝脏单核细胞吸收饱和有关。
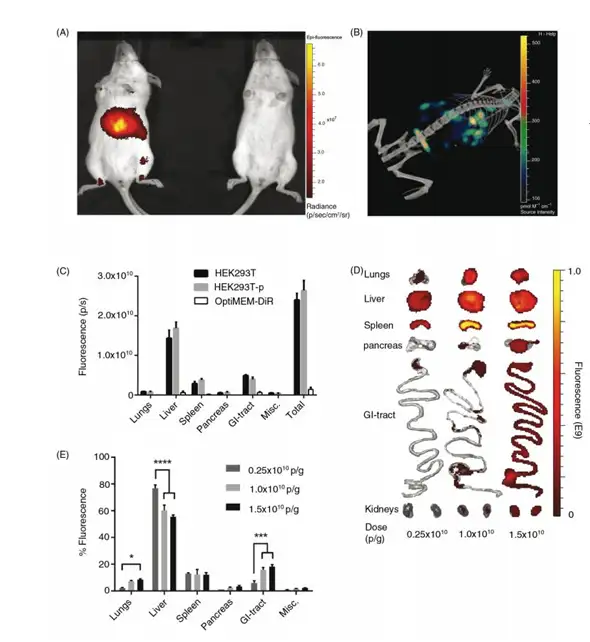
左图. EVs 显示剂量依赖性的组织摄取的增加 Oscar P. B. Wiklander et al., Journal of Extracellular Vesicles 2015, 4: 26316
随后,Oscar P. B. Wiklander 使用 IVIS 系统又考察了不同细胞来源的EVs在组织分布的 差异,在此选取了一个肌肉细胞系(C2C12)、黑色素细胞系(B16F10)和骨髓来源的未成 熟的DCs。结果显示DiR标记的不同来源的EVs在肝脏、脾脏、肠道和肺都有较高的积累, 但是分布有差别,C2C12-EVs 在肝脏分布较高(71%±1.5)、而 B16F10-EVs分布(56%±2.2) , DC-derived EVs 分布最低(46%±0.9)。而肺部的分布则相反, C2C12-EVs 肺部分布仅 (5%±0.5), B16F10-EVs (13%±1.5) 以及 DC-EVs (10%±0.9)。B16F10-EV 在 GI-tract 分布 相较另两组更多为15%±3.3,C2C12-EVs (8%±1.3)和DC-EVs (10%±0.8)。有趣的是,DC-EVs 显示在脾脏累积增加(28%±1.3)而 C2C12-EVs 和 B16F10-EVs 具有相似的分布分别为12%±1.5 和 12%±0.6(图C/D),可以推测EVs根据细胞的类型具有归巢的效应。
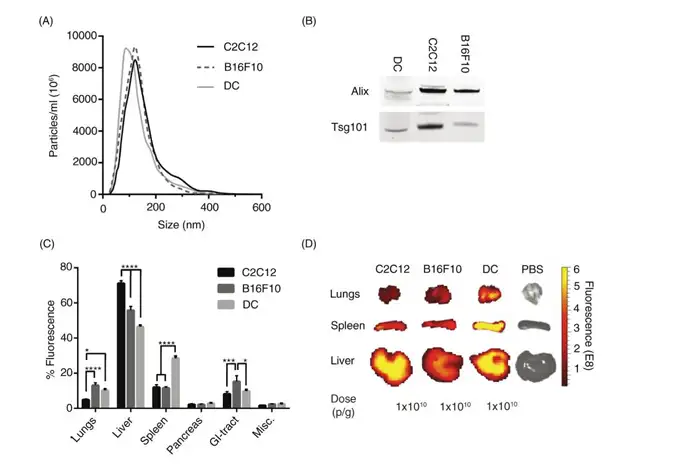
上图:不同细胞类型 EVs 分布Journal of Extracellular Vesicles 2015, 4: 26316
三.治疗相关研究
在治疗领域,由于外泌体来源细胞胞浆,含有细胞成分,所以具备了细胞的部分功能, 也能代替细胞完成治疗作用。Exovita Biosciences公司,利用外泌体治疗癌症。与免疫治疗 的方法不同,Exovita并非要调动免疫系统,而是调动正常人体细胞杀灭癌细胞。这个新鲜 的技术正是该公司的独门绝技。专注于再生医学的BioRegenerative公司,其创始人是加州 大学圣地亚哥分校的教授,用干细胞分泌的外泌体生产美容、生发、干眼病、创伤烧伤的愈 合绷带、喷雾剂等产品,其效果非常好。
如晚期非小细胞肺癌的外泌体临床试验所观察到的,外泌体可以发挥免疫调节 作用,从而潜在地影响疾病进展。
间充质干细胞(MSC)的治疗作用可能是其外泌体发挥作用的,因为从MSC 纯化的外泌体可以发挥与MSC治疗相似的作用。例,老年性痴呆、脑损伤的 干细胞治疗,因为干细胞无法穿过血脑屏障,但外泌体能进入大脑发挥作用。 治疗心梗,干细胞分泌的外泌体治疗效果比干细胞还好。因为干细胞容易被内 脏吸附、摄取或清除,真正到达损伤部位的干细胞只有5~10%。而100纳米的 外泌体体积小,大概只有细胞的1%,能更顺畅地到达靶标。
MSC来源的外泌体已经被认为是退行性疾病或者损伤的潜在的治疗方法,有望成为 细胞治疗的替代品。然而MSC来源的外泌体首微环境的影响。Zongjin Li 教授利用释放一氧化氮(NO)的聚合物,增加外泌体促进血管新生的功能。 模型为小鼠的后肢缺血模型,且小鼠血管内皮生长因子受体2启动子下插入luc的 基因 (Vegfr2-luc),因此可以监测血管的修复。使用NO激活的hP-MSCs来源的外泌 体,监测外泌体对血管的修复作用。救过显示NO处理的,hP-MSCs来源的外泌 体能够显著增加血管新生。
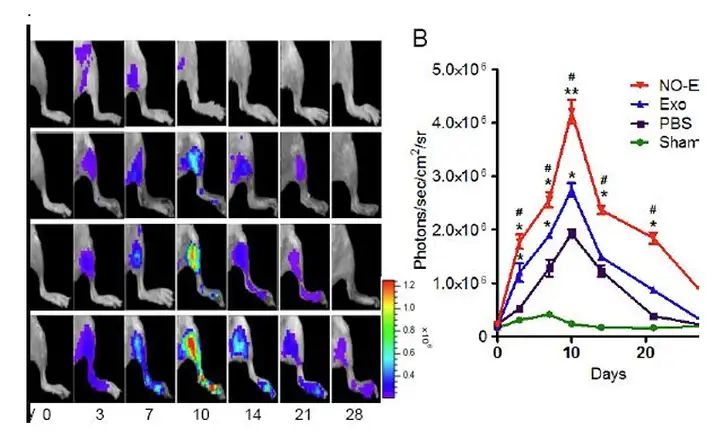
上图:NO增加外泌体促进血管新生的活性(Journal of Extracellular Vesicles 2015, 4: 26316 -)
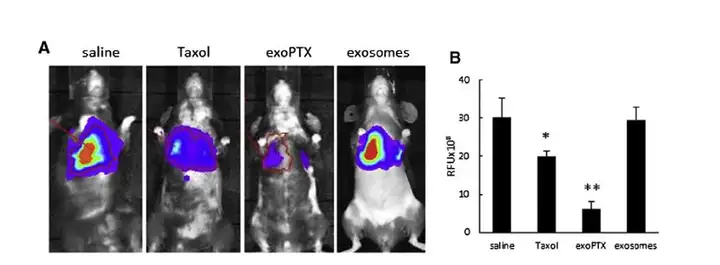
上图.脂质体作为载体包括紫杉醇,用于肿瘤治疗.M.S. Kim et al / Nanomedicine: Nanotechnology, Biology, and Medicine 12 (2016) 655–664
领域:细胞生物学