2024-5-17 14:01
Revvity小动物活体光学成像技术已在生命科学基础研究、临床前医学研究及药物 研发等领域得到广泛应用。尤其药物研发已经是活体光学成像技术应用的热点领域。 利用小动物光学成像技术可在活体水平 1.对治疗肿瘤、炎症、感染性疾病、神经性 疾病等疾病的药物药效学进行评价;2.对药物在动物体内的分布代谢靶向进行研究 ;3.对药物毒性进行评价。Revvity的小动物活体光学成像技术已广泛应用于药物的临 床前研发阶段,在药物研发中应用已经非常成熟,全球各大制药企业均已采用活体光 学成像技术开展抗肿瘤、抗感染等药物的研发,其中已有6种药物获得FDA认证,另有8种药物处于临床测试阶段。

药效学评价
1. 抗肿瘤药物药效学评价
抗肿瘤药物药效学评价是小动物光学成像技术的基础应用之一,利用荧光素酶标 记肿瘤细胞,并移植入动物体内建立肿瘤疾病动物模型,给药后应用小动物活体光学 成像技术观测肿瘤光学信号随时间的变化情况,进而评价不同药物、特定的给药途 径、时间、剂量等给药策略对于肿瘤的治疗效果,如下图就利用小动物活体光学成像 技术评价了PD-0332991(PD-991)、阿瓦斯汀(Avastin)、多西他赛(docetaxel,TXT) 的抗肿瘤效果。
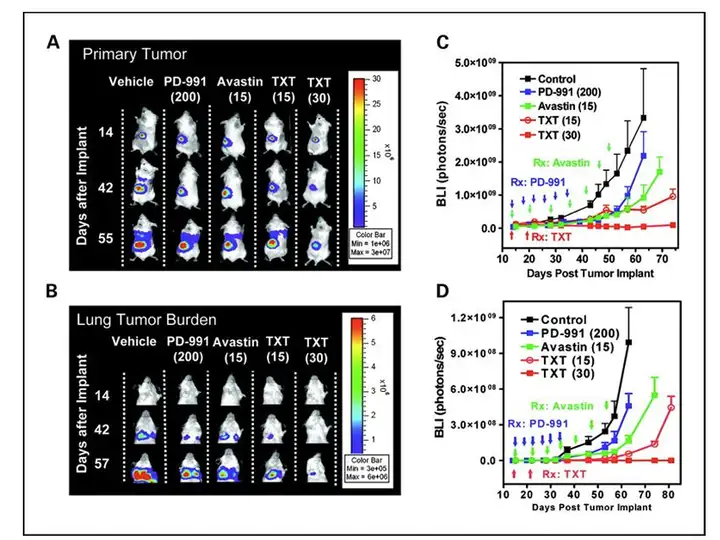
药效评价研究:利用萤火虫荧光素酶标记MDA-MB-435乳腺癌细胞株,将细胞注入小鼠肾包膜下构建肾包 膜肿瘤模型,进而对3种不同药物或不同剂量的治疗效果进行评价。(A,C)应用IVIS成像系统长期观测3 种药物对肾包膜乳腺癌移植瘤的治疗效果,并进行定量分析,结果显示30 mg/kg Docetaxel(TXT)对肿瘤 的生长抑制效果最好;(B,D)应用IVIS成像系统长期观测3种药物对肾包膜乳腺癌移植瘤肺部转移的抑 制效果,并进行定量分析,结果显示30 mg/kg Docetaxel(TXT)对肿瘤转移的抑制效果最好。
Zhang et al.,Clin Cancer Res.2009;15(1):238-46.
相对于触诊、肿瘤体积测量等传统方法,利用高灵敏度的生物发光成像技术进行 药物评价,可以更灵敏的发现残余病灶点或尽早发现肿瘤的复发,从而更准确的对药 物治疗效果进行判定,如下例:
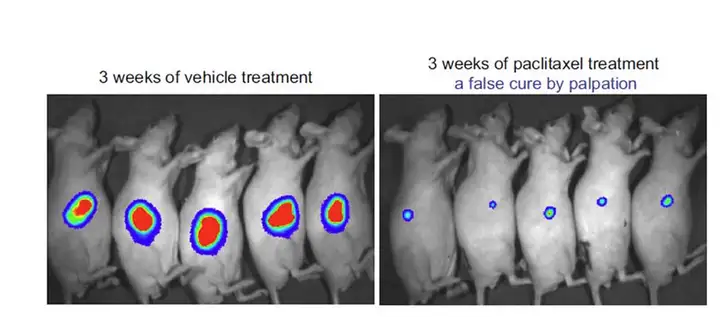
提高药效评价准确性:利用萤火虫荧光素酶标记PC-3M人前列腺肿瘤细胞株,建立肿瘤皮下移植模型进 行药物评价。左图:对照组,右图:治疗组。通过高灵敏度的生物发光成像技术可以准确检测出药物治疗 后的残余病灶点,从而进行正确的药效评价,而如果通过触诊等传统方法则可能做出错误判断。
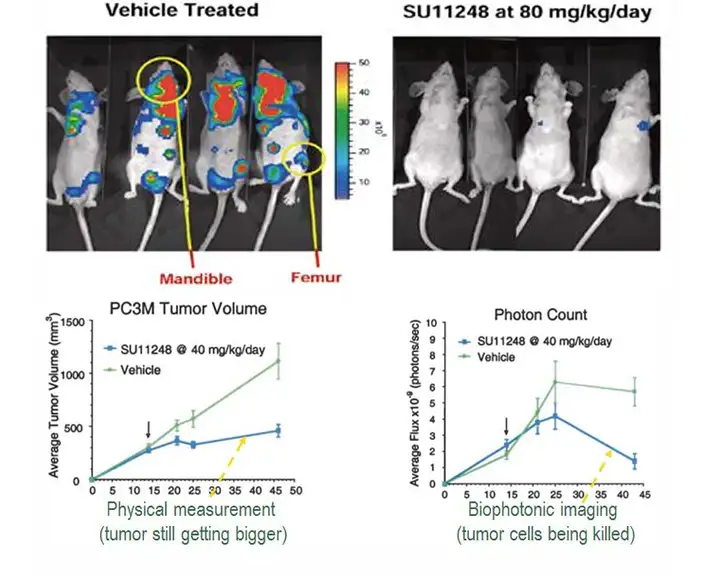
利用生物发光成像技术进行药效评价的另一独特优势在于,可以明确判断药物是 否有效杀死肿瘤活细胞。这是由于生物发光的原理是基于活细胞环境的酶促反应,因 此,能够发光的细胞必定是具有活性的。下图所示为辉瑞公司抗肿瘤药物Sutent的部 分研究结果,研究人员首先利用卡尺测量肿瘤体积的方法观测该药物对于肿瘤的生长 抑制情况,发现该药物能够延缓肿瘤的生长,但体积测量数据显示肿瘤并未变小,研 究人员随后利用生物发光成像技术进行观测,发现给药一定时间后肿瘤光学信号显著 降低,说明该药物对肿瘤活性细胞确实具有杀伤作用,同时说明单独依靠肿瘤体积测 量的方式无法准确真实反映药物治疗效果。凭借活体光学成像的实验结果,Sutent得以 顺利通过FDA的认证。
2.抗感染药物药效学评价
研究者在健康和粒细胞减少CD-1小鼠腹腔注射细菌荧光素酶标记耐甲氧西林的金 黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MSSA)建立腹腔炎小 鼠模型。应用不同抗生素治疗腹腔炎小鼠,Revvity的 IVIS系统成像显示服用达托霉素 (Daptomycin)小鼠的生物发光强度显著下降。结果说明达托霉素相对于其他抗生素 。
药物(包括萘夫西林,万古霉素,利奈唑胺)显示更强和更快地杀菌活性,对腹 腔炎的治疗效果更显著。
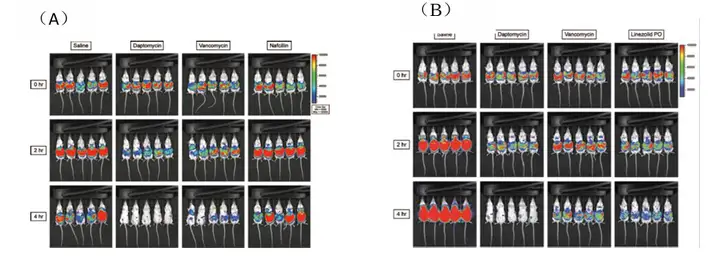
上图:健康(A)和粒细胞减少(B)CD-1小鼠建立的腹腔炎模型。服用Saline(盐水),Daptomycin(达托霉素),Vancomycin(万古霉素),Nafcillin(萘夫西林)或者Linezolid(利奈唑胺)。
Mortin et al., Antimicrobial Agents and Chemotherapy, 2007,51(5): 787–1794
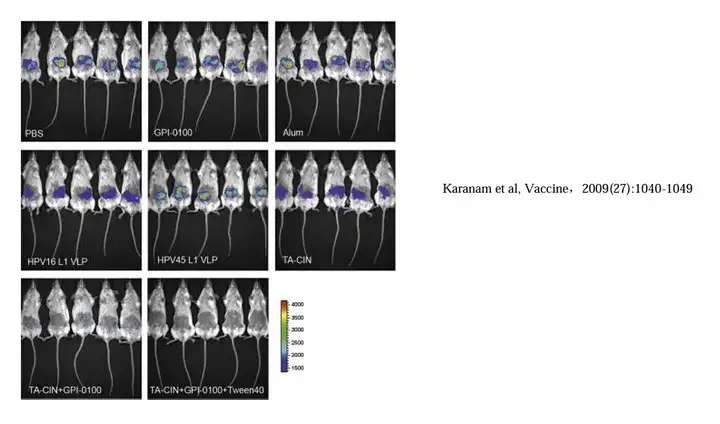
人乳头瘤病毒(Human papillomavirus, HPV)诱导引发宫颈癌。萤火虫荧光素酶 标记人乳头瘤病毒皮肤感染的BALB/c小鼠模型,Revvity的 IVIS系统成像显示病毒的 生物发光强度在皮下接种TA-CIN和GPI-0100疫苗的小鼠中明显消失,说明这两种疫 苗能够极大地抑制人乳头瘤病毒的生长(下图)。
与细菌、病毒感染研究类似,研究者也可通过荧光素酶基因标记寄生虫,观测其 在活体动物体内的感染情况。如Claes等人利用IVIS系统观测了经海肾荧光素酶基因 标记的布氏锥虫(Trypanosoma brucei)在小鼠体内的感染情况。体内及体外成像结果 显示,经腹注射后,布氏锥虫选择性分布于睾丸。布氏锥虫在睾丸的选择性分布可能 会使其避开药物的作用,因为许多药物无法通过睾丸-血管屏障而进入睾丸。随后的给 药实验印证了这种推断,在布氏锥虫感染小鼠5天后,用虫草素(cordycepin)连续进 行三天处理,停药后在第15天发现睾丸处重新出现布氏锥虫生物发光信号。这一研究 为开发治疗布氏锥虫感染的有效药物提供了依据。
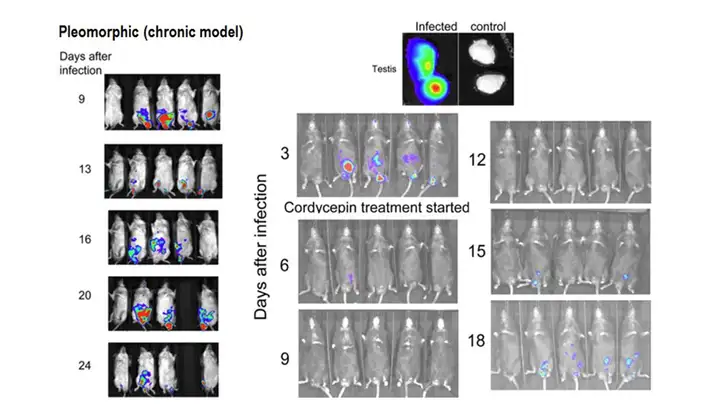
上图:应用IVIS系统观测布氏锥虫在小鼠体内的感染情况。左,感染后不同时间点活体成像结果;右上,取出睾丸后体外成像结果;右下,虫草素对布氏锥虫的治疗效果观测。
3. 抗炎症药物药效学评价
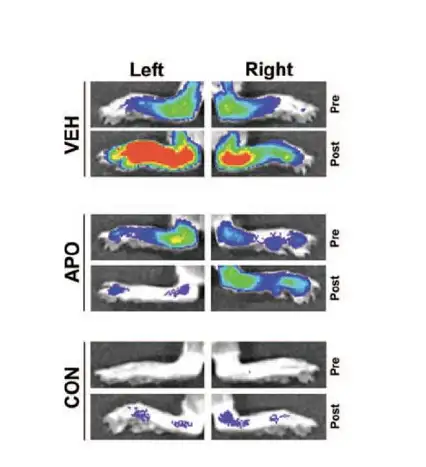
治疗关节炎药物药效学评价:小分子 APO866 是 前 B 细胞集落增强因子(Pre-B cell colony-enhancing factor, PBEF ) / 烟 酰 胺 磷 酸 核 糖 转 移 酶 ( nicotinamide phosphoribosyltransferase, NAMPT)抑制剂。为了研究前 B 细胞集落增强因子/烟酰胺 磷酸核糖转移酶在炎症性关节炎疾病中的调节作用,研究者将胶原蛋白诱导的关节炎 小鼠灌输APO866药物。静脉注射MMPSense750靶向的荧光试剂,监测基质金属蛋白 酶活性而反映疾病炎症。Revvity的 IVIS 系统成像显示服用 APO0866 的小鼠金属蛋白 酶活性下降,说明APO886能够通过抑制前 B细胞集落增强因子/烟酰胺磷酸核糖转移 酶治疗炎症性关节炎。
治疗系统炎症药物药效学评价:小动物光学成像技术进行抗炎症药物的研究,主 要是借助炎症光学动物模型即萤火虫荧光素酶标记 NF- κB 基因的小鼠来实现, ( Nuclear factor-κB (NF- κB) 是细胞内转录因子,NF- κB 对细胞凋亡,肿瘤发生,自体 免疫疾病和炎症有重要作用,NF- κB 的表达往往伴随着炎症的发生和发展。牛樟菇 (Antrodia camphorate)是产自台湾的一种传统中药,牛樟菇可以治疗食物中毒,药物中 毒,痢疾,腹痛,高血压,皮肤瘙痒和肝癌,在此研究中主要评价牛樟菇对炎症的治 疗效果。模型小鼠通过腹腔内注射脂多糖(Lipopolysaccharide, LPS)后建立炎症的模 型,使用Revvity的 IVIS系统成像系统生物发光成像可实时检测NF- κB在用药前后的 表达水平,进而评价牛樟菇对炎症的治疗效果。从下图可以看出小鼠服用牛樟菇后, 炎症小鼠的生物发光强度下降(下图左)。体外验证显示牛樟菇治疗后肠系膜淋巴结 ,肝脏,脾脏和肾脏的生物发光强度下降(下图右)。结果说明牛樟菇能够有效抑制 脂多糖引发的炎症反应。
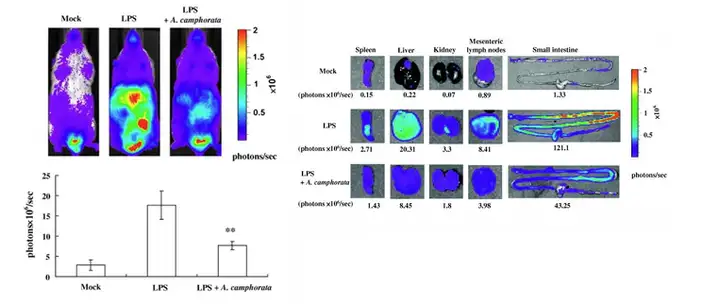
上图:(A)应用LPS(脂多糖),LPS+A.camphorate(脂多糖和牛樟菇),Mock(阴性对照)后小鼠生物发光和定量结果。(B) 体外Spleen(胰脏)Liver(肝脏)Kidney(肾脏),Mesenteric lymph nodes (肠系膜淋巴结),Small intestine (小肠) 的生物发光成像。
Hseu et al, Food and Chemical Toxicity, 2010(418):2319-2325
帕金森症是一种神经退化型疾病,神经炎症被认为在神经细胞的损伤和凋亡过 程中起了很大作用。在大脑的黑质致密部递送抗炎症和抗氧化剂可以有效的抑制神经 炎症和增加细胞活性,然而血脑屏障是进行大分子和蛋白质递送到大脑的主要屏障。 研究人员使用 MPTP 帕金森小鼠模型,进行纳米制成的过氧化氢酶(Nanozyme, 抗炎 试剂)负载骨髓巨噬细胞的递送。Revvity的 IVIS成像系统结果显示,在骨髓巨噬细胞 的帮助下,过氧化氢酶可以成功的穿过血脑屏障进入到大脑,从而治疗帕金森症。
左.MPTP 帕金森小鼠模型静脉注射不同物质(A)荧光标记的过氧化氢酶负载骨髓巨噬细胞(B)过氧化氢酶负载荧光标记的巨噬细胞(C)荧光标记的过氧化氢酶。
Brynskikh et al, Nanomedicine (2010) 5(3), 379–396
5.脂肪代谢相关药物药效学评价
ThermoMouse 是一种新的转基因报告小鼠,可允许研究人员实时地研究活体动物 中的棕色脂肪活性。相关研究结果发表在最近一期的《Cell Reports》杂志。棕色脂肪 燃烧能量的这种能力,其关键是解偶联蛋白1(UCP1),在该小鼠模型中当UCP1表达 时,荧光素酶随之表达。因此通过生物发光检测荧光素酶的表达,则可实时检测UCP1 的表达,因此该模型可鉴定药物对肥胖的治疗效果。
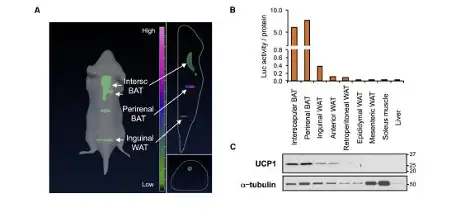
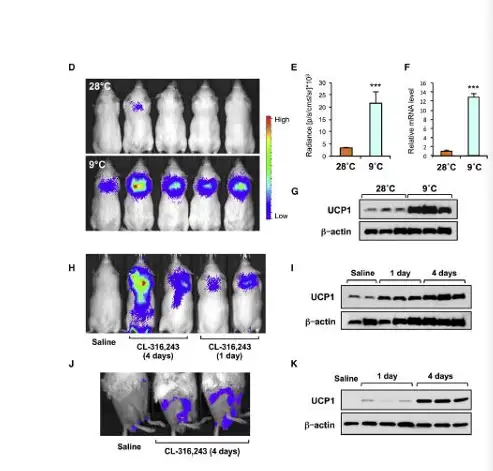
图1:左,利用IVIS系统生物发光成像检测ThermoMouse转基因小鼠UCP1表达;(A) ThermoMouse报告鼠中生物发光3D重构信号,特定荧光素酶信号已经表明体脂类型;(B)室温下荧光素酶定量结果:脂肪、骨骼肌,、肝脏、脂肪定量结果已经用蛋白含量进行校准;(C) B中小鼠不同组织UCP1蛋白表达分;.(D) 28℃饲养条件
Galmozzi et al., 2014, Cell Reports 9:1584–1593
减肥后脂肪量恢复的细胞过程具有普遍性,瘦素的mRNA水平与脂肪量有着密切 关系,因此瘦素的表达可以代表脂肪含量的改变。瘦素(Leptin,LP)是一种由脂肪组 织分泌的激素,人们之前普遍认为它进入血液循环后会参与糖、脂肪及能量代谢的调 节,促使机体减少摄食,增加能量释放,抑制脂肪细胞的合成,进而使体重减轻。为 了进一步研究在不同条件下脂肪含量的变化,在此研究中建立了一种转基因小鼠,在 该小鼠体内重组的荧光素酶基因的表达受瘦素表达调节序列的调控,因此可以利用生 物发光来非侵入实时监控瘦素的表达,从而衡量脂肪含量的变化,评价减肥药物的使 用效果。研究结果表明,1、该转基因小鼠瘦素的表达水平与荧光素酶活性高度一致, 可以通过活体成像检测荧光素酶的表达来真实反映瘦素的表达量;2、在禁食后,重新 给予喂食6h后,瘦素表达增加,但是此时脂肪并未合成,因此提示脂-殆尽的脂肪细胞 在脂肪组织的滞留,在瘦素治疗实验中同样验证了这一论点。
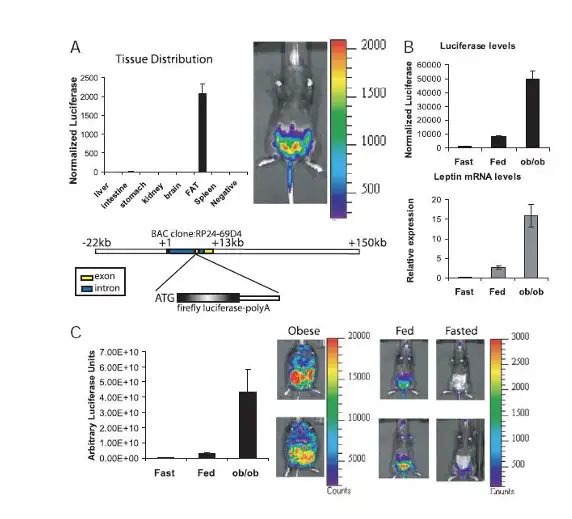
上图.(A)leptin-luciferase转基因小鼠中荧光素酶在各组织中表达特性,荧光素酶活性由组织裂解后蛋白量进行标准化处理;下方是荧光素酶在转基因小鼠体内插入的位点示意图;(B)在禁食、喂食、ob/ob小鼠中荧光素酶和瘦素的相对表达,上排位荧光素酶活性,下排为瘦素的表达采用实时定量PCR的方法检测;(C
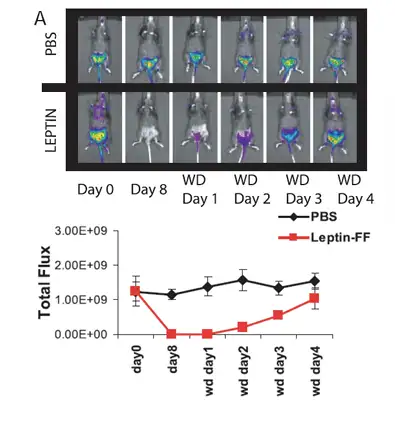
左图. 瘦素治疗对脂肪组织和荧光素酶表达的影响Klvanc¸ Birsoy et al.,PNAS, 2008.105 ( 35): 12985-12990
药物分布靶向研究
除了在药效学中的应用,小动物活体光学成像也广泛应用于药物在体内靶向、分 布及代谢的研究。与药效学中的应用不同,此类应用是以药物为直接观测对象,因此 标记方式通常是利用荧光探针直接标记药物本身,通过追踪荧光信号而反映药物在体 内的分布情况。如在研究抗体或多肽类药物是否能够有效靶向肿瘤的实验中,可以利 用荧光染料通过化学键的结合标记目标抗体或多肽,经尾静脉注射后,利用小动物活 体光学成像系统观测上述标记对象的肿瘤靶向性,如下图:
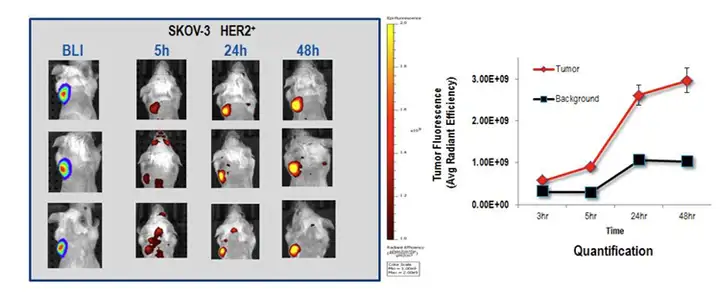
上图:利用VivoTag 645 荧光染料标记抗癌药物曲妥珠单抗(Trastuzumab),尾静脉注入携带HER2阳性人卵巢癌SKOV3的SCID小鼠体内,通过荧光成像观测不同时间点药物对肿瘤的靶向情况(左上图后三列),肿瘤本身已被荧光素酶标记而通过生物发光成像(左上图最左列),右上图为荧光定量分析结果,标明曲妥珠单
在研究药物靶向的同时,了解不同时间点药物在动物体各个器官的分布及最终代 谢情况同样必不可少。Revvity的FMT小动物活体荧光断层成像系统可以很好的满足此 类应用需求。应用FMT成像系统,能够对荧光标记的药物在深层器官的分布进行断层 扫描及三维重建,获得真实准确的三维定量数据,进而对药物的体内分布代谢情况作 出正确分析。如下图:
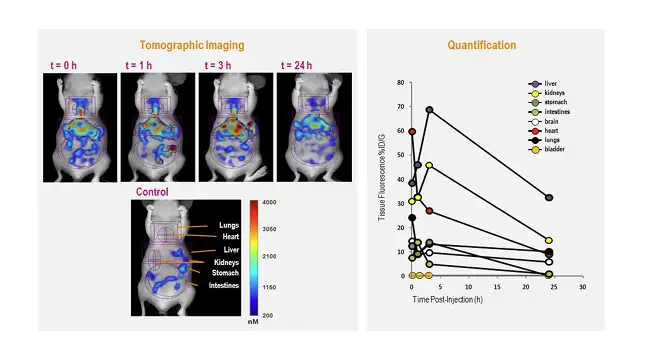
上图左:利用FMT成像系统观测不同时间点经荧光染料VivioTag 680标记的BSA在小鼠不同器官的分布;上图右:不同时间点不同器官BSA分布的定量结果。
在对药物分布进行研究时尤其是小分子药物,同位素标记被视为金标准。原因是 用相对大分子量的荧光染料标记小分子药物,荧光染料本身即会对小分子药物在体内 的分布代谢产生影响,因此活体荧光成像技术并不是研究小分子药物的最佳方法。 Revvity IVIS成像系统基于其超高的检测灵敏度,可采集放射性同位素产生的切伦科夫 (Cerenkov)光信号,即带电粒子在某特定介质中以超过光在该介质中的相速度运动时产 生蓝光,利用这种现象对放射性同位素标记的小动物进行成像称之为切伦科夫成像。 例如Jeong Chan Parka利用124I-标记药物赫赛汀,尾静脉注射荷瘤小鼠体内后,利用 Revvity IVIS成像系统检测其在肿瘤的分布。
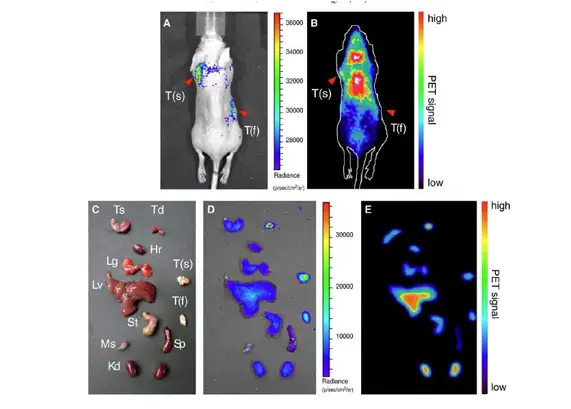
上图:Cerenkov 和PET 成像检测124I-标记药物赫赛在肿瘤的分布,红色箭头指示的为肿瘤的位置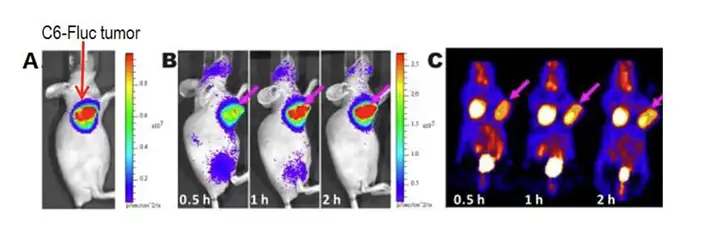
切伦科夫辐射成像:应用IVIS成像系统结合[18F]FDG放射性探针观测肿瘤。A.肿瘤生物发光成像结果;B. 应用IVIS系统进行切伦科夫辐射成像,观测不同时间点[18F]FDG在肿瘤部位的代谢;C.应用PET系统成 像,观测不同时间点[18F]FDG在肿瘤部位的代谢,结果与B一致。
事实上,直接通过荧光染料标记药物注入体内的方式存在诸多问题,如低靶向 性、低药效性、免疫排斥、药物毒性问题等。因此,构建新型药物载体也是目前药物 研究的热点之一,应用小动物活体光学成像技术同样可以在这一领域发挥作用。如下 图所示为研究人员通过小动物活体光学成像技术观测一种新型纳米共聚物给药载体在 体内运载吗啉基反义寡核苷酸靶向治疗肿瘤的实验。此类给药载体包含多种组分,如 起整体保护作用的外层多聚苹果酸骨架及聚乙二醇、起肿瘤靶向作用的抗体连接组 分、药物释放组分、荧光染料结合位点等。结果表明,通过应用新型纳米给药载体可 以有效提升药物的靶向治疗效果。
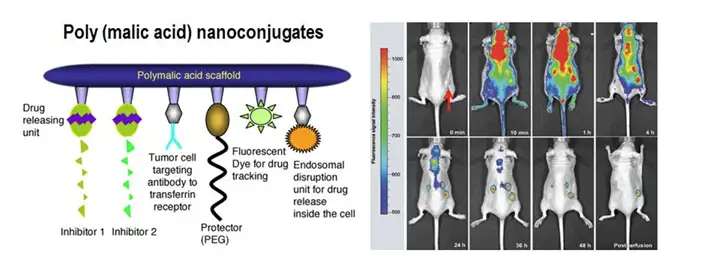
上图左:新型纳米共聚物给药载体结构示意图;上图右:应用IVIS成像系统观测不同时间点药物运载系统在体内的分布及对肿瘤的靶向。
药物毒性研究
除了进行药物靶向及分布代谢研究之外,小动物光学成像技术还可用于评价药物 的毒性。其中肝毒性评价是药物研发的一个关键模块,而许多药物在临床研究甚至上 市后才发现严重肝毒性,这对药物开发公司和用药患者都带来了巨大的损害。斯坦福 大学Shuhendler教授在2014年发表一篇文章,在文章中就设计并研发了一种药物肝毒性指示剂,可以根据药物肝毒性的大小,发出不同的光。其原理是基于肝毒性的两个关 键生物标志物——活性氧(reactive oxygenspecies,ROS)和活性氮(reactive nitrogen species,RNS),二者的产生机制不同,因此对两者同时检测可广泛的检测药物的毒 性。此指示剂是一种半导体聚合物纳米粒(semiconducting polymer nanoparticle,SPN),包含三个核心元件:(1)靶向元件:通过聚乙二醇联连接半乳糖 残基,可以与肝细胞表面的半乳糖受体结合,是一种常见的肝靶向方法;(2 )活性氧 感应元件:化学发光剂双草酸酯( CPPO) 在活性氧存在的条件下,迅速分解产生高能 中间体1,2-二氧杂环丁烷二酮,激发附近染料分子发光,检测发出的光子强度即可评价 活性氧的程度;(3)活性氮感应元件:青色素染料IR775S发射680nm、820nm两种荧 光,因荧光能量偏振转移(FRET),发射的680nm的光子作为激发光激发染料分子发 射出820nm的光,而680nm光子减弱甚至消失;而在活性氮存在的条件下,FRET现象 消失680nm荧光信号增强,检测此信号的强度即可评价活性氮的强度。
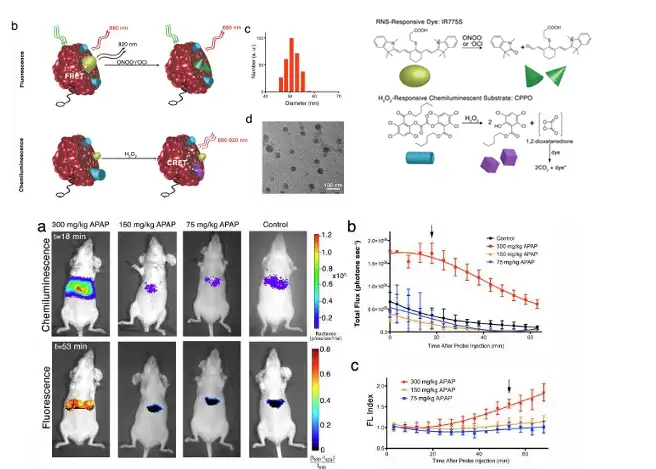
上图,不同剂量扑热息痛(anti-pyretic acetaminophen,APAP)对小鼠肝脏毒性的影响。
Nat Biotechnol. 2014 April ; 32(4): 373–380.
同样也可以通过监测与机体损伤相关基因的表达来评价药物的毒性。其中血红素 氧化酶1(Heme oxygenase-1,HO-1)就是一个关键的检测目标。物质代谢、能量代 谢、药物和毒物的生物转化,都涉及氧化还原过程,并伴随大量活性氧簇(reactive oxygen species,ROS)的生成,而刚才也提到活性氧已经被认为是药物毒性的一个标 志。大量研究显示,凡引起细胞ROS 水平增加的外来刺激,如毒性药物、重金属、毒 素等,大都能使HO-1的表达增加,起到抗氧化的作用,因此HO-1基因的表达可以用来评价药物的毒性。将荧光素酶的基因插入小鼠HO-1基因启动子下游建立HO-1-Luc 转基因小鼠,即可应用生物发光的成像模式实时检测HO-1基因的表达,进而评价药物 的毒性。 如下图所示
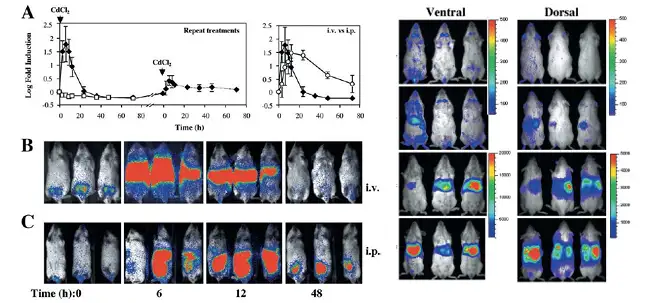
上图左.HO-1-luc模型小鼠在尾静脉或者腹腔注射CdCl2(10 μM)后HO-1表达随时间的变化,A左.尾静脉注射CdCl2或PBS后进行长时间检测,并且当CdCl2组HO-1表达接近对照组时,重新注射CdCl2,A右.尾静脉与腹腔注射CdCl2进行比较;B、C分别为尾静脉或腹腔注射CdCl2后进行生物发光成像的图像。右.不同剂量CdCl
Weisheng Zhang.et al.J Mol Med (2002) 80:655–664
血清淀粉样蛋白A(Serum amyloid A,SAA)是一种急性期反应蛋白,血中浓度主要 由合成速度决定,而肝功能正常时其合成主要决定于细胞因子的水平。当组织发生感 染、炎症或者损伤时,SAA可以诱导产生组织损伤修复过程所需的酶,吸引免疫细胞 到达炎症部位加强免疫反应作用。若药物会引发机体产生损伤或炎症时,SAA的表达 会迅速上升,因此SAA也可以作为药物毒性的一个标志物。同样我们建立SAA-Luc转 基因小鼠即可评价药物对肝脏的毒性,如下图所示:
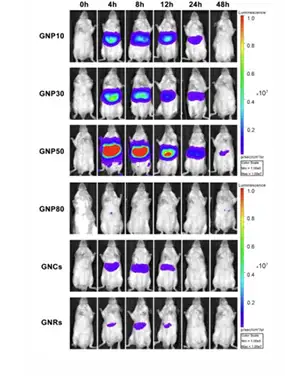
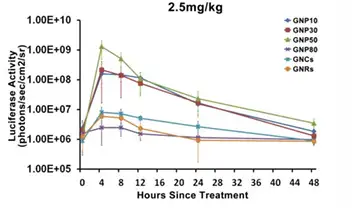
左图.Balb/c小鼠,尾静脉注射GNP10/GNP30/GNP50/GNP80/GNRs/GNCs等 6种纳米金材料,注射浓度2.5mg/kg小鼠体重。分别在注射材料前,注射后4h/8h/12h/24h/48h进行活体荧光成像监测。
药物代谢酶CYP3A在药物代谢中发挥重要的作用,药物对CYP3A的诱导表达可 加速合用药物的代谢,因此CYP3A的表达水平可以评价药物在肝脏的代谢情况。在进 行实验时,可将荧光素酶基因重组到小鼠CYP3A基因的表达盒中,构建CYP3A-luc转 基因小鼠,当药物经过肝脏进行代谢时,CYP3A的表达增高,同样荧光素酶的表达也 随之增加,在注射底物荧光素时,即可产生生物发光的信号,信号的强度即代表了药 物肝代谢的水平。目前CYP3A4-Luc转基因小鼠,并且已经被用于快速、大量筛选观 察药物在肝脏代谢情形及中草药对药物代谢的影响。
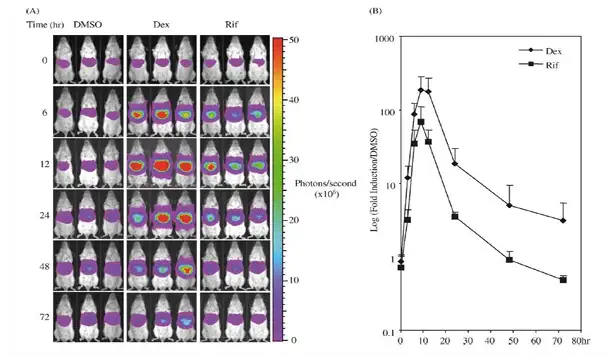
上图:利用转基因小鼠观察地塞米松(Dex),利福平(Rif)经肝脏的代谢情形。
W. Zhang et al.Biochemical Pharmacology 65 (2003) 1889–1896
领域:细胞生物学