![]() 型号:双足平衡测定仪
型号:双足平衡测定仪
![]() 品牌:玉研仪器
品牌:玉研仪器
![]() 产地:上海
产地:上海
双足平衡测试仪是通过大鼠、小鼠自身的平衡调节来评估疼痛程度的方法。
动物的双脚分别着力于两块不同的称重板上,正常鼠会将体重平均分配到两只脚上,两个测重板的数据差值很小;如果其中一只脚存在发炎、病变或神经疼痛,根据严重程度,老鼠会自发地将体重转移到另外一只脚上,导致两块测重板的重量出现相应的差值。该方法在药筛和安评中被广泛应用。
双足平衡测量来评价疼痛与压力测痛仪测量的结果具有很好的相关性。
独特功能:
· 全自动测试,操作方便
· 触屏操作,USB导出数据,Excel格式输出
· 磁性脚垫设计,易于组装和清洗
· 适用于大鼠和小鼠

型号:47883/47882
产品特点:
被广泛使用的方法
· 引用次数超过1500次;
· 测量后肢的重量分布,该方法在新款的Ugo Basile设备中得到更新;
自动测试功能
· 具备自动化开启测量模式,使整个实验过程更简单和省力;
触屏操作和USB数据存储功能
· 可以快速设定参数,控制仪器和管理数据;
· 数据可直观显示;
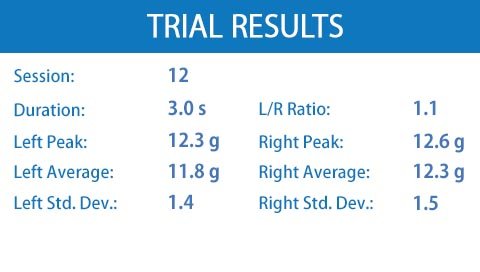
· 附带移动U盘,可以存储所有测试数据(包括平均爪重,标准偏差,左右比率等)
· 数据能够以图表形式直观实时;
结果精确可靠
· 高精度力传感器,分辨率为0.1g;
· 校正简单;
· 非常耐用,没有其它易损或需要经常更换部件;
· 数据重现性好;
· 每次实验后,结果可以自行筛选,数据可通过软件导出,兼容EXCEL格式的文件;
便于清洗
· 磁性脚垫设计,易容移除和固定;
· 平板式设计,没有死角,容易清理;

大鼠和小鼠测试鼠笼
实时的测量数据

用于将csv数据导出到PC的USB密钥和各连接器
产品主要规格:
| 主机尺寸 | 13x25x31cm |
| 重量 | 2.6Kg |
| 输出数据文件 | .csv格式(可在MicrosoftExcel中打开) |
| 测量分辨率 |
小于500g:0.05g 全量程:0.1g |
| 最大重量 | 单足2200g |
| 精度 | 0.50% |
| 适用动物 | 大鼠、小鼠 |
| 测试结果 | 持续时间、训练次数、力量峰值、平均值、每个爪的标准偏差和左/右比率 |
| 每次实验结束后直接计算 | |
| 内部存储器 | 4GB,多达10.000次以上的实验 |
| 测量时间 | 1-360秒 |
| 测量启动模式 | 手动、自动模式可选 |
| 电源 | 90-260VAC,无风扇(静音) |

小鼠双足平衡测试仪

大鼠双足平衡测定仪
双足平衡测定仪的部分相关文献:
1.Argueta, Donovan A., et al. "Palmitoylethanolamide Attenuates Pain-like Behavior in Factor VIII Deficient Mice."Blood140.Supplement 1 (2022): 5578-5579.doi:10.1182/blood-2022-159745
IF 25.48
2.Shi, Yuanyuan et al. “A small molecule promotes cartilage extracellular matrix generation and inhibits osteoarthritis development.”Nature communicationsvol. 10,1 1914. 23 Apr. 2019, doi:10.1038/s41467******
IF: 17.69
3.Cao, Chenxi et al. “Cholesterol-induced LRP3 downregulation promotes cartilage degeneration in osteoarthritis by targeting Syndecan-4.”Nature communicationsvol. 13,1 7139. 21 Nov. 2022, doi:10.1038/s41467******/span>
IF: 17.69
4.Kwon, Hyuk-Kwon et al. “A cell-penetrating peptide blocks Toll-like receptor-mediated downstream signaling and ameliorates autoimmune and inflammatory diseases in mice.”Experimental & molecular medicinevol. 51,4 1-19. 26 Apr. 2019, doi:10.1038/s12276******/span>
IF: 12.15
5.Batchelor, V., J. Miotla-Zarebska, and T. L. Vincent. "REFINING METHODS TO MEASURE SPONTANEOUS PAIN BEHAVIOUR IN SURGICALLY INDUCED MURINE OSTEOARTHRITIS."Osteoarthritis and Cartilage30 (2022): S381. doi:10.1016/j.joca.2022.02.513
IF 7.51
6.Cheng, Jin, et al. "RIP1 perturbation induces chondrocyte necroptosis and promotes osteoarthritis pathogenesis via targeting BMP7."Frontiers in Cell and Developmental Biology9 (2021): 638382. doi:10.3389/fcell.2021.638382
IF 6.08
7.Sur, Bongjun et al. “Inhibition of Carrageenan/Kaolin-Induced Arthritis in Rats and of Inflammatory Cytokine Expressions in Human IL-1β-Stimulated Fibroblast-like Synoviocytes by a Benzylideneacetophenone Derivative.”Inflammationvol. 42,3 (2019): 928-936. doi:10.1007/s10753******/span>
IF: 4.66
8.Villa, Thea et al. “Fangchinoline Has an Anti-Arthritic Effect in Two Animal Models and in IL-1β-Stimulated Human FLS Cells.”Biomolecules & therapeuticsvol. 28,5 (2020): 414-422. doi:10.4062/biomolther.2020.113
IF: 4.23
9.Carlesso, Lisa C et al. “Use of IMMPACT Recommendations to Explore Pain Phenotypes in People with Knee Osteoarthritis.”Pain medicine (Malden, Mass.)vol. 23,10 (2022): 1708-1716. doi:10.1093/pm/pnac044
IF: 3.64
10.Surcheva, Slavina, et al. "Preclinic and clinic effectiveness of gabapentin and pregabalin for treatment of neuropathic pain in rats and diabetic patients."Biotechnology & Biotechnological Equipment31.3 (2017): 568-573.doi:10.1080/13102818.2017.1290550
IF:1.77
11.Miotla-Zarebska, Jadwiga et al. “Modeling and Assessing Osteoarthritis in Mice by Destabilization of the Medial Meniscus (DMM).”Methods in molecular biology (Clifton, N.J.)vol. 2598 (2023): 357-373. doi:10.1007/978-1******26
IF: 0.39