2024-5-08 17:07
细胞萤光素酶报告基因检测受多种因素影响,例如载体状态,细胞状态,转染量,转染效率,裂解效率,加样精度等等,因此实验中一般需要做3个或以上复孔,且最好采用双萤光素酶报告基因,以保证实验结果的可信度。现将双萤光素酶实验检测中常见的问题汇总如下:
Q1:如何选择载体?
萤火虫萤光素酶一般选取pGL-3、pGL-4或pmirGLO的载体,也可自己构建相应的载体;
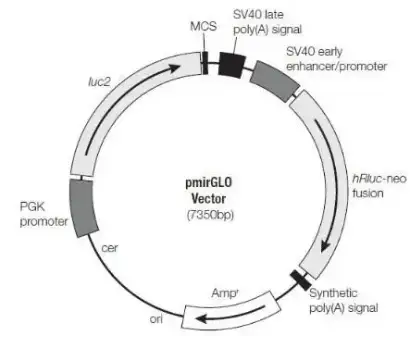
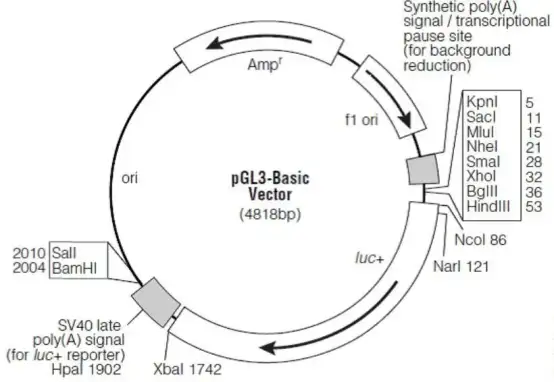
海肾萤光素酶一般选取phRL-TK或pGL-4载体,建议不使用强启动子(如SV40,CMV),而选取中等强度的启动子
Q2:检测结果萤光值过低或无萤光值怎么办?
多种情况均可导致检测结果萤光值过低或无萤光,具体原因和解决办法如下:
1,启动子活性低
a.优化细胞的培养条件,提高萤光素酶的表达量;
b.更换强启动子(如SV40、CMV)。
2,转染效率低
a.优化转染实验条件,用较易转染的质粒做阳性对照(如转染过表达萤光蛋白质粒);
b.确保转染DNA的质量,可通过酶切或琼脂糖凝胶电泳的方法对DNA质量进行鉴定;
c.选择活性较高,处于指数分裂期的细胞进行转染。
3,样品裂解效率低
a.细胞培养时间不宜过长,12-36h内最好,长时间培养后,细胞可能会难裂解;
b.加入的裂解液需足量,保证细胞能够充分裂解。
4,检测过程操作不规范
a. 选择合适的检测仪器,如Luminometer 发光计、多功能酶标仪或者其他能够检测生物发光的仪器都适用于该实验;
b.需加入足量底物,保证底物的饱和,否则会造成检测结果出现很大偏差;
c.保证室温反应。酶促反应对温度较为敏感,反应时各个组分(细胞裂解产物,底物工作液等)都需要调整到室温(20-25℃)再使用;
d.萤光素酶的体外半衰期一般约30min,加完底物后可立即检测,尽量在30min内完成;
e. 检测板:为防止孔间干扰,推荐使用不透光白色酶标板。黑色酶标板也可用,但因黑色会吸收光信号,可能会降低信号。
5,底物氧化失效
a.底物避光密封保存,萤火虫萤光素酶底物-20℃保存;海肾萤光素酶底物推荐-80℃保存;
b. 反应工作液建议现用现配。
Q3:如何判断转染成功?
1,如转入的miRNA带萤光标记如GFP,则可直接在转染后、细胞裂解前,显微镜下观察细胞萤光;
2,如转入的miRNA不带任何萤光标记,可考虑进行miRNA的qRT-PCR检测,通过检测结果判断实验组2、4、6是否相对其对照组miRNA有显著过表达;
3,设置一个萤光质粒转染参照组,同批转染一个组的细胞,间接反映出同批次实验的转染情况。
Q4:细胞裂解物可以存放多久?
常温一般不超过6小时,-20℃可以保存一个月,-80℃可以保存半年。
Q5:萤光素酶作为报告基因相比于萤光蛋白有哪些优势?
萤光素酶的灵敏度相比于GFP提高10-100倍以上,同时具有更宽的动态范围,便于数值分析比较,不需要萤光显微镜,而且在活体实验中其萤光穿透性高于GFP等萤光蛋白,同时由于没有内源活性、其本底信号很低。而GFP等萤光蛋白相比于萤光素酶的优势在于可以进行示踪定位,并且其观测不需裂解细胞,方便进行适时观察。
Q6:为什么我的实验复孔无法重复?
实验复孔有一定差异是正常的,通常只要在一个数量级之内即可。如果差异超出这个范围,则需要考虑以下2个方面,一是细胞裂解后离心取上清,保证样本均一性;二是保证加样的准确性,移液器要定期校准,确保移液精准。
Q7:检测结果萤光值越高越好么?
萤光值过高可能会超出仪器检测范围从而检测不到结果,一般读数在5-6之间较好,萤光值过高可通过减少质粒转染量或对裂解产物进行稀释后检测,不建议通过减少萤光底物来降低萤光值,因为底物饱和才能反映萤光素酶真实的表达水平,否则会造成检测结果出现大的偏差。
萤光素酶实验的应用
萤光素酶作为报告基因技术的一种,具有快速、灵敏、准确的优点,常应用于以下几种生物学研究:
1,启动子活性分析:启动子区是RNA聚合酶的结合区,启动子的结构直接关系到转录的效率,萤光素酶实验可用于验证待测启动子是否有活性及其活性区域;也可实现组织特异性启动子筛选及确定;以及用于新顺式作用元件发现及功能鉴定。
2,启动子与转录因子的结合验证:将待检测的启动子序列构建在报告基因上游,同时在细胞实验中共表达转录因子,分析萤光素酶表达水平,即反映转录因子是否调控基因的表达,转录因子能增强或抑制启动子的启动能力。
3,验证microRNA与靶基因是否存在调控关系:microRNA主要通过作用于靶基因的3’UTR起作用,microRNA大部分通过成熟体种子区与3’UTR结合抑制蛋白翻译。可以将目的基因3’UTR区域构建至报告基因luciferase的下游,再共转入microRNA,如果萤光素酶表达下降,可以说明microRNA对目的基因的抑制作用;
4,启动子SNP分析:单个核苷酸变异,简称SNP,通过构建萤光素酶报告基因系统研究SNP位点的增强子与转录因子是否结合最为直接。
5,分析信号通路是否激活:将待检测信号通路的下游相应元件序列构建入报告基因载体,检测不同上游条件下,其萤光素酶活性,即下游信号通路的响应情况。
CHASELECTION逐典萤光素酶报告基因检测试剂盒旨在准确、灵敏、高效地测定萤火虫萤光素酶活性,应用高通量药物筛选、药物活性检测、大规模启动子功能测定、信号通路等研究。
逐典萤光素酶报告基因
针对报告基因检测不同的侧重需求,逐典推出了3种检测系统。

逐典萤光素酶报告基因优势:
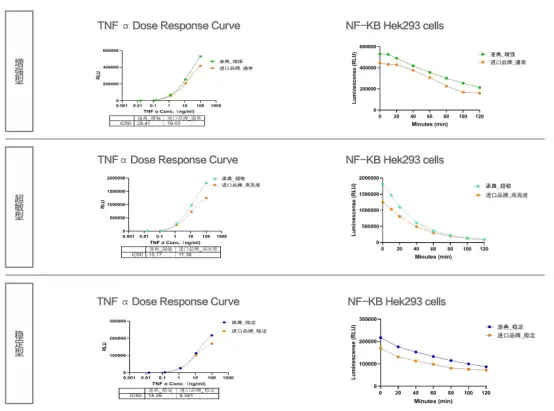
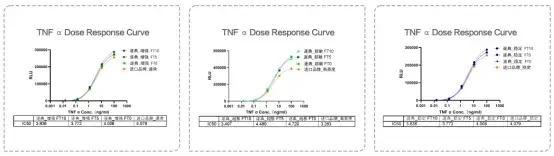
1. 检测灵敏度高,信号稳定性好
HEK293-NFK B-LUC细胞加入梯度稀释的TNF 在37C、5%CO条件下刺激6小时后,分别用增强型、超敏型、稳定型检测试剂进行信号检测。
2. 操作方便
仅需将底物和萤光素酶检测缓冲液混合后直接加入到细胞即可。

3. 稳定性好
同时在10次反复冻融实验中,逐典全系列报告基因检测试剂盒显示出较强的稳定性。
领域:细胞生物学