2024-04-25 13:29
本篇文章已经开通留言功能,
欢迎至文末留言交流讨论!
反相色谱肽分离色谱柱和流动相研究
第三部分:建立色谱柱表征数据库

将肽反相色谱柱表征方案38种色谱柱,这些适用于肽的分析色谱柱的配基、基础硅胶、封端和孔径各不相同。基于方表征案测试低pH值和中等pH值下的肽探针之间的保留时间差异,以计算选择性Delta值。探索正电荷或负电荷(脱酰胺)、空间效应(例如氨基酸顺序的外消旋以及序列颠倒)、氧化和芳香基团部分的增加/减少。由于适用于小分子的色谱柱数据库(包括Snyder疏水减法模型和扩展的Tanaka方案)不能用于肽类的反相色谱柱选择性表征,这一事实凸显了开发专门用于肽分析的表征方案的必要性。主成分分析表明,肽RPC色谱柱表征方案构建的色谱柱知识库可用于鉴定具有相似或不同色谱选择性的色谱柱,分别用于选择性备用色谱柱或方法开发柱。本文还证实,固定相上带正电荷的官能团的存在是有利的,因为它产生了非常不同的色谱选择性和并提供了更好的峰形。
01引言
在过去的几十年中,具有不同配基官能团的色谱柱数量大幅增加。这种更大的化学空间范围大大增加了色谱柱-分析物相互作用,使色谱工作者可以应用不同的色谱选择性。然而,过多的选择可能会使色谱柱选择成为一项艰巨的任务。固定相的选择是影响选择性的最关键参数,会影响色谱方法开发的成功。通过选择具有不同色谱特性的固定相,可以最大限度地提高选择性差异的可能性,从而提高方法开发过程的效率。另外,选择具有相似色谱选择性的固定相也是鉴定该方法备用色谱柱的一项重要活动。进行这两种活动的一种有效方法是比较已表征固定相的数据库中的色谱柱选择性。文献中描述了定义明确的色谱柱表征方案,这些方案利用小分子作为探针来建立固定相的相互作用。互联网上有两个最大的免费数据库,它们分别使用了Snyder的疏水减法模型或Euerby等人[1-7]的扩展Tanaka方法。
然而,小分子色谱柱表征方案与肽分析的相关性很小。因此前文开发且认为应使用相关探针(即肽探针)表征固定相,以评估用于肽分离的色谱柱[8]。随着肽RPC色谱柱表征方案的最新发展,现在可以表征与肽分离方法相关的相互作用的固定相 [9,10]。该方案使用梯度色谱法表征低pH值和中等pH值下的固定相,其中使用的溶剂在参考中被优化[9]。方案之初设计了26个探针来研究选择性,迭代评估后,显著减少了所需的肽数量,仍能以最少的实验量充分描述色谱柱[9]。前文还使用简化的因子设计对协议的稳健性进行了耐用评估,以确定必须仔细控制哪些变量以确保方案的完整性[10]。最终能确保稳健性所需的最终方案可以在前文找到[10]。其中包括进一步减少本研究中应用的最终方案中使用的肽的数量和以及观察的Δ值[10]。
将新开发的基于肽的方案应用于几家不同的色谱柱制造商提供的43根色谱柱上,所得结果的数据库可向通讯作者索要。使用主成分分析(PCA)对结果进行整理和评估。为了验证该方案预测选择性相似性能力,从PCA中选择了一系列色谱柱,以相似性和差异性两种角度出发,使用碳酸酐酶和牛胰岛素的胰蛋白酶消化物进行验证。还将该方案与基于小分子的表征方法进行了比较,以确定其选择适当的固定相进行肽分离的必要性。最后,该方案还指出了新色谱柱化学的潜在特征方向,这些特征可用于进一步提高分离选择性。
02实验
2.1.化学品和试剂
使用的所有水、乙腈和流动相添加剂(甲酸铵 (AF) 和甲酸 (FA))均为 LC-MS 级,由 Sigma Aldrich(Poole, UK)提供。二甲基亚砜(DMSO)由Fisher Scientific(Hemel Hempstead, UK)提供。由Apigenex(Prague, Czech Republic)提供的肽全部溶解在DMSO/H2O(80:20 v/v)中,浓度为0.25 mg/mL。用于消化蛋白质的碳酸酐酶、牛胰岛素、胰蛋白酶、TRIS碱、TRIS HCl和盐酸,由Sigma Aldrich提供。肽探针的进一步描述见参考文献[9,10]。
2.2.仪器
在岛津Nexera X2 UHPLC系统(Duisburg, Germany)进行LC分离,该系统配备了两个二元泵(LC-30AD)和比例阀、脱气机(DGU-20ASR)、具有冷却功能的自动进样器(SIL-30AC)、Prominence柱式烘箱(CTO-20AC)、二极管阵列检测器(SPD-M30A)和通信总线模块(CBM-20A)。岛津单四极杆质谱仪(LCMS 2020)被用作二级检测器。LC仪器的梯度滞留体积为342 μL,系统保留体积为14 μL [11]。
2.3.固定相
所有色谱柱均为制造商提供的新色谱柱,并使用统一的 150 × 2.1 mm 的标准化色谱柱规格。本研究共测试了来自多家色谱柱制造商的 43 种固定相扩展了多肽 RPC 色谱柱表征数据库,这些固定相的配体、孔径和基础硅胶各不相同。该数据库可应要求从通讯作者处获得。表1中提供了评估的每个阶段的简要说明。水峰顶点被用作死时间标记[11]。


表1
2.4. 色谱柱表征方案
肽RPC色谱柱表征方案的程序描述和确保方案完整性的缓解措施均在参考文献[10] 的附录1中描述。肽RPC色谱柱表征方案将与扩展的Tanaka方案和Snyder疏水减法模型进行比较,Tanaka方案和Snyder疏水减法模型在文献中有很好的描述[1-4,6,7,12-15]。
2.5. 蛋白质消化
将胰蛋白酶分别以 1:20 的比例加入到碳酸酐酶或牛胰岛素(均为 0.4 mg/mL)中,并溶解在 pH 7.5 的 50 mM TRIS 缓冲液(7.4 mM TRIS 碱和 42.6 mM TRIS HCl)中。将溶液在37°C下储存24小时。通过加入 37% HCl 将 pH 值降低至 2.5(将 3 mL HCl 加入 20 mL 样品中)来停止消解。使用低pH值或中等pH值对消化物进行色谱分析。在低pH条件下,水组分使用0.1%甲酸溶液,有机组分使用0.1%v/v甲酸乙腈溶液。中间pH条件使用20 mM甲酸铵水溶液作为水相,纯乙腈用于有机相。两种流动相的梯度如下:5–60%B超过60分钟,在60%B下保持2分钟,然后在0.1分钟内降至初始条件,并重新平衡12分钟(相当于10个色谱柱体积)。
2.6.软件和计算
使用LabSolutions控制液相色谱仪器并进行数据处理 (Version 5.86, Shimadzu, Duisburg, Germany). 使用(SIMCA (Version 14.1, Umetrics, Umeå, Sweden)和 Origin (Version OriginPro 2016, OriginLab, Northampton, MA, USA) 做主成分分析。使用GPMAW software (Version 9.51, Lighthouse Data, Odense, Denmark)计算电荷。
03
结果/讨论
3.1. 主成分分析
每个固定相都使用九个肽探针评估;牛GLP-2的1-15部分有3个,牛GLP-2的16-33部分有6个,所有9个探针仅相差一个氨基酸残基,以评估固定相对这些探针的细微选择性差异。完整的 33 个氨基酸序列倾向于形成高级结构,因此该序列切分为两个,其中第一个碱基序列包含氨基酸 1-15,第二个碱基序列包含氨基酸 16-33(牛-GLP-2 (1-15) 和牛-GLP-2 (16-33))。选择性(称为delta,Δtg ∗)由某些修饰肽与其相应的原始碱基序列(肽编号1或13,表2)之间的归一化保留差异([9,10])决定。Delta值可以评估氧化、负电荷变化、空间相互作用(如外消旋和氨基酸序列中的交换)、芳香族和酚类相互作用以及正电荷变化的影响。使用圆二色谱的初步研究判断出在流动相中肽缺乏二级结构。然而,后来发现观察到的选择性差异可能只能通过固定相的疏水性乙腈/配体层中肽的会形成二级结构来解释[9,16-18]。
使用PCA整理和评估每个固定相的Delta值,大约82%的变异性可用两个主成分描述,第三个主成分可增加 10%的描述,但使视觉比较变得复杂。因此,将主成分的数量限制在两个以内。每个固定相都根据色谱柱的先验知识和 PCA 评分图中的位置进行分类。

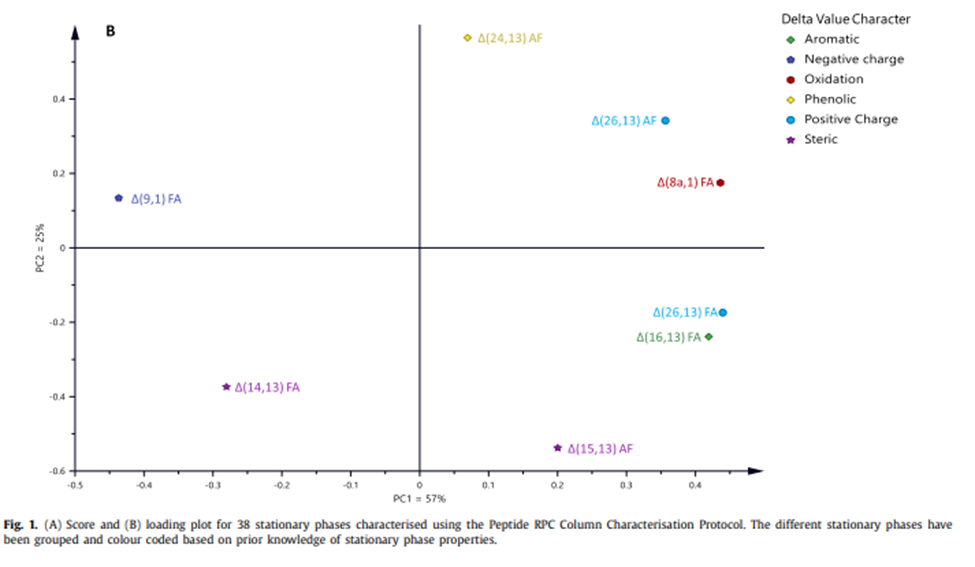
图1
图1A中的Score -plot图表明,存在高静电相互作用(正负)区域和低静电/极性相互作用区域。负电荷/极性固定相特性主要位于Score-plot图的右上象限,也与正电荷探针 Δ (26,13) AF、芳香族/酚类特性探针 Δ (24,13) AF 和氧化探针 Δ (8a,1) FA 的增加一致(图 1B)。与Δ(26,13)FA相比,Δ(26,13)AF探针在识别具有负电特性的固定相方面可能更重要,因为在中间pH值下存在带负电荷的硅醇基团。芳香族/酚类特征探针可以区分可以与酪氨酸取代基的羟基形成氢键的色谱柱,与芳香族配体部分形成pi-pi相互作用。其也有可能基于空间相互作用区分色谱柱,因其结构中较大的侧链可能会改变固定相疏水乙腈层内肽的二级结构[9,16,17]。氧化作用探针还能够在低pH值下与可及的硅醇基团形成氢键,因此其在loading-plot中的位置也可以合理解释。右下象限的低静电相互作用区域可以用Δ (15,13) AF 和 Δ (16,13) FA 来表征,这主要评估空间相互作用。Δ (26,13) FA也位于右下象限,其位置不太明显。具有带正电荷官能团的固定相位于分数图的左上象限和左下象限,这与加载图中负电荷探针 Δ (9,1) FA 的一致(图 1B)。
右下象限的中性基团由大量具有高配体密度和末端封端的烷基的色色谱柱组成。这些色谱柱(绿色圆圈)包括 C18 烷基配体,以及 Acquity BEH C8、Poroshell HPH C8 和 Kinetex C8。中性固定相簇的一个例外是Kinetex C18的位置,它位于负电/极性色谱柱内,靠近Poroshell SB-AQ。基于扩展的 Tanaka 协议或疏水减法模型数据,使用 PCA 将 Kinetex C18 与其他 C18 烷基相进行比较,并未表明其在当前研究中存在差异的任何潜在合理性。因此,与其他C18色谱柱相比,目前尚不清楚为什么Kinetex C18在肽表征中显示出更多的极性。有趣的是,在诺和诺德的肽分析过程中,Kinetex C18色谱柱与其他C18色谱柱相比,在许多情况下显示出不同的选择性(未发表的结果)。
右上象限的蓝色方形标记表示负电/极性色谱柱。这些色谱柱要么在配体化学中具有负电部分,要么通过低配基密度或不封端而包含显著的亲硅相互作用,要么具有可以促进二氧化硅表面作用的配体结构。该基团包含苯基相,如苯基己基、二苯基和联苯色谱柱,其中配基结构使得肽探针可以潜在地接触二氧化硅表面及其硅醇基团[19,20]。此外,还有两种五氟苯色谱柱,它们具有形成静电π-π相互作用的能力。该类别还包含 Acquity HSS C18-SB、Acquity BEH C4、Poroshell SB-AQ、Zorbax SBC8、Zorbax SB-C18 和 Zorbax SB-C18 300,它们都是非封端色谱柱,具有低配体密度,可促进硅醇相互作用。尽管 Acquity BEH C4 由于烷基链较短而减少了疏水相互作用,并且没有封端,但它实际上位于中性烷基相内。这可能与预期相反,但该色谱柱基于杂化二氧化硅,与溶质相互作用的硅醇基团较少。此外,与C18型色谱柱相比,较小的配基通常产生更高的表面覆盖率。PLRP-S是一种疏水性聚合物色谱柱,不含硅醇基团。然而,它在分数图中的位置表明,这个色谱柱具有极性或负电保留机制。这可能归因于色谱柱上存在带负电荷的阳离子交换位点,或者固定相的苯官能团与带正电荷的肽[22]之间存在阳离子-π芳香族相互作用。Acclaim WCX 是一种具有羧酸配基的混合模式固定相。由于亲水肽在中间pH条件下被其电离化羧酸配体的负净电荷的排斥,Acclaim WCX未包含在PCA中。然而,在中性pH 值甲酸铵体系下使用,色谱柱带负电,这种类型的色谱柱将位于负电/极性特征组内。而在低pH值下, Acclaim WCX的行为类似于C-烷基相。
带正电荷官能团的固定相分散在score-plot图的左上象限和左下象限内,由Acquity CSH系列、Luna Omega PS C18、Poroshell 120 Bonus-RP和Polaris Amide C18组成。这些色谱柱使用扩展的 Tanaka 协议进行表征,其中可以使用苯磺酸和甲苯之间的选择性 (α(BSA/T)) 来测量正电性特性。带负电荷的苯磺酸保留在色谱柱上,表明该色谱柱具有正电性。这些结果意味着Polaris Amide C18和Poroshell Bonus-RP都是在两步过程中合成,其中未反应/非酰化氨基带正电,因此能够进行静电相互作用[13]。CSH系列和Luna Omega PS C18均设计为具有少量的正表面电荷,以改善低pH值和低离子强度下带正电荷的化合物的峰形[20,23]。
需要注意的是,Ascentis Express F5、Bioshell CN、Bioshell C18 和 AdvanceBio peptide Map色谱柱未包含在 PCA分析的结果中。甲酸铵体系里Ascentis Express F5 对多个带多个带正电荷的肽有过强保留,起初的假设是色谱柱上氟化芳环相关的致密负电荷。对比对于Kinetex F5或Poroshell PFP来说,它们在芳香和偶极子特性方面具有在Tanaka方案上与Ascentis Express F5相似的特性。比较而言Ascentis Express F5 具有更强的硅醇活性,正如 α(B/P pH 7.6) 和 α(B/P pH 2.7) 的扩展 Tanaka 方案结果所强调的那样,这可能有助于在甲酸铵体系中对带正净电荷的肽产生额外保留。Bioshell CN可以使用甲酸条件进行表征,表现出典型的峰形和保留。疏水肽在甲酸铵条件下可以令人满意地保留,但亲水肽在过早洗脱。这令tg∗的测定无法完成。由于烷基连接端短,二异丙基氰丙基相的疏水性有限,因此其疏水性不足以保留亲水肽。在扩展Tanaka方案中测量的中间pH条件(α(B/P pH 7.6))下的亲硅相互作用也表明该色谱柱存在一些负电特性,这也可以解释负净电荷亲水肽的保留不足。Bioshell C18和AdvanceBio peptide MAP色谱柱上,在甲酸铵体系的梯度时间内,可以洗脱探针肽。然而,在甲酸条件下,疏水肽不能从固定相中洗脱。梯度扩展到100%MeCN,在原始梯度上使用相应的%B/min变化,但没有成功。这表明这些色谱柱具有显着的强的疏水保留能力,可能更适合疏水性较低的肽,而Bioshell CN更适合疏水性较强的肽。相比之下,当使用TFA作为添加剂时,所有肽均可在Bioshell C18和AdvanceBio peptide Map 色谱柱上洗脱。这很难比对 TFA 进行比例分析,因为 TFA 是一种比甲酸更疏水的离子对。AdvanceBio peptide Map 色谱柱在 TFA流动相下供了出色的峰形。因此,本文表征了 38 个固定相,而不是最计划的 43 个。
PCA分析使用户能够可视化固定相之间的差异或相似之处。例如,假定位于近距离的色谱柱具有相似的选择性,而远离的色谱柱可以被视为色谱多样性。这有助于指导固定相的设计。很明显,尽管疏水相互作用在反相色谱法中占主导地位,但还有其他重要的相互作用,即极性和静电相互作用。
研究肽分析的专家可能特别感兴趣的是包含某种形式的电荷或极性官能团的色谱柱。一些最多样化的选择性可以在这些类型相互作用的色谱柱上实现,例如Polaris Amide C18,Acquity CSH氟苯基和Acclaim WCX。这些色谱柱能够与肽发生静电和/或极性相互作用,并且根据pH值可以具有不同的相互作用模式。使用甲酸或甲酸铵表征数据的棒状图,将这些色谱柱与中性的Ascentis Express C18相进行比较(图2)。

图2
Ascentis Express C18被选为标准C18型固定相进行比较。结果表明,带电肽在具有正电或负电的色谱柱上的保留性不同。Ascentis Express C18(图2D)是中性相,酸性硅醇活性低,因此固定相与肽之间的相互作用模式主要是疏水作用。Acclaim WCX在甲酸条件下具有与中性C18相相似的洗脱曲线,这表明保留主要与WCX配体官能团的烷基比例有关。与Ascentis Express C18相比,[Tyr26]-肽24在Acclaim WCX上具有更大的相对保留性,这可能表明极性羧酸部分与酪氨酸肽之间的极性相互作用,例如氢键。Acquity CSH 氟苯基和 Polaris 酰胺 C18(分别为图 2B 和 C)对大多数肽具有相似的保留性,其中带正电荷的 [Gly22] -肽16、[Tyr26]- 肽24 和 [Lys26]-肽26与肽1和 [L-Asp11]-肽 9。[Lys26]- 肽 26的相对保留变化程度大于其他肽,因为其正净电荷更大(表 2)。带正电荷较强的疏水肽在Polaris Amide C18上受更大的排斥力,因为Polaris Amide C18在配体上具有较高的正电荷,因此具有更窄的洗脱窗口。这在扩展的Tanaka方案中也很明显,其中带负电荷的苯磺酸被大大保留在Polaris Amide C18上[13]。
在甲酸铵流动相体系中间pH条件下,Acclaim WCX带负电荷,导致带负电荷的亲水肽在未保留。与其余肽相比,[Lys26]-肽26的正净电荷和完全离子化的WCX配体作用,选择性与评估的其他固定相明显不同。Polaris Amide C18 和 Acquity CSH 氟苯基虽然在低 pH 值下色谱相似,但在中等 pH 条件下表现出显着的选择性差异。Polaris Amide C18 上的阳性特征仍然存在,这表现为 [Lys26]-肽26的相对保留率较低,而带负电荷的肽1 和 [L-Asp11]-肽9与相同条件下的其他色谱柱相比具有更大的保留。另一方面,Acquity CSH 氟苯基的选择性似乎类似于 Acclaim WCX,这表明固定相具有更大程度的负电特性。这可能是由于封端二氧化硅导致在中间pH值下带负电荷的硅醇基团数量增加,导致带负电荷的肽发生排斥,而对[Lys26]-肽26的正净电荷保留更强。
在图2的四个色谱柱中比较肽[Lys26]-肽26在甲酸和甲酸铵中的峰形。与低pH条件下相比,甲酸铵条件下C18相的峰形显著改善(峰宽从0.107减小到0.052),原因就是甲酸的低离子强度所致。在两种流动相条件下,Amide C18都具有良好的峰形,峰宽分别为0.054和0.074,证明了该色谱柱在甲酸等低离子强度添加剂体现初其正电特性。在两种流动相条件下(0.100和0.093),氟苯基色谱柱也产生相似的峰宽,但与Amide相比,其峰更宽。WCX色谱柱在低pH和中pH下产生的峰宽分别为0.154和0.161。请注意,如图2所述,这些色谱柱之间的颗粒类型和粒径不同。图1A中的score plot图表明,左上象限有一个空白空间,该空间可以被具有正电特性的混合模式相位占据,可提供与标准C18色谱柱完全不同的选择性,同时保持出色的峰形(有关峰容量的讨论,请参见第3.2节)。尽管混合模式相具有选择性潜力,但在实验室内的成功实施取决于批次间的重现性,这对于许多传统的SCX、WCX和混合烷基/SCX或WC色谱柱来说一直很差。较新的混合模式相需要评估批次间的可重复性,当前研究表明,它们可能为固定相开发提供一种有趣的替代选择性。
3.2.峰容量
样品峰容量(PC∗∗)用于测量甲酸和甲酸铵的分离性能,基于公式1计算样品中第一个和最后一个洗脱分析物之间可以分离的峰数[24]。该测量值来表征保留窗口中特定色谱柱的性能。
公式1
其中,和是第一个和最后一个洗脱肽的保留时间,Wave是所有分离峰的碱基平均宽度,非对映异构氧化蛋氨酸探针(肽编号8)除外,这些探针在大多数固定相上通常分离得很差。补充材料中记录了第一个和最后一个洗脱肽的平均峰宽和保留时间。甲酸体系中固定相的PC∗∗值范围在22-155(平均值91)之间,而甲酸铵条件的范围为72-272(平均值189),这说明了与甲酸相比,使用甲酸铵可以产生更高的性能。Acclaim WCX、PLRP-S 和 Polaris Amide C18 固定相在甲酸条件下的 PC∗∗ 分别为 50、64 和 83,而甲酸铵条件在 Polaris Amide C18 上产生的 PC 值为 72。应该注意的是,与评估的大多数其他相相比,这些色谱柱具有更大的粒径(全多孔颗粒 (TPP) 3 μm 对比TPP 1.8 μm 或 2.7 表面多孔颗粒 (SPP))。因此,预计在减小粒径时,峰值容量应增加约1.4倍。流动相水溶液中的甲酸铵为20 mM,足以通过减少相互排斥效应来改善峰形。McCalley等人认为,在基本物质(例如本研究中使用的带正电荷的肽)中经常观察到的峰形较差,与相同电荷的吸附离子之间的相互排斥引起的过载有关[21,25,26]。
甲酸流动相会加剧这个问题,因为其离子强度不足,其中0.1%甲酸v/v溶液的离子强度约为2 mM,而20 mM甲酸铵溶液的离子强度为20 mM。然而,甲酸流动相对于具有一定正电荷的色谱柱,如Polaris Amide C18、CSH系列固定相和Luna Omega PS C18,可以产生可接受的峰值容量水平[23]。这些色谱柱可以改善碱性物质的峰形,其中甲酸和甲酸铵之间,正电性状固定相的峰宽和10%峰高处的不对称因子平均分别降低了43%和24%(数据未显示)。这与中性和负电固定相形成鲜明对比,甲酸和甲酸铵之间的峰宽平均增加37%,拖尾平均增加30%。尽管峰宽较窄,但在Polaris Amide C18上观察到的PC∗∗值低于预期。这归因于与其他色谱柱相比,洗脱窗口更窄,在甲酸和甲酸铵中,洗脱窗口平均分别小27%和32%。这是PC∗∗测量的潜在局限性,如果洗脱窗口比对照色谱柱窄,则可能会给结果带来错误的印象。然而,这可以通过将常规峰容量(PC-方程(2))方程应用于所有固定相来解决,其中两种不同的测量相互补充,以提供色谱性能的概览。甲酸中的PC值在71-561(平均值297)之间,而甲酸铵在122-470(平均值341)之间。Polaris Amide C18 的 PC 值在甲酸中增加到 421,在甲酸铵中增加到 173。PC∗∗和PC测量都存在局限性,前者可能由于洗脱窗口窄而低估了该值,而后者可能会高估分离能力,因为峰不会在整个梯度时间内洗脱。然而,当结合使用时,它们可以准确地表示固定相的色谱性能。
方程2
3.3. 肽反相色谱柱表征方案与基于小分子的方案的比较
肽反相色谱柱表征方案旨在弥补用于肽分离的固定相的色谱柱表征方法的缺陷,其中代表目标分析物的探针最适合表征固定相。将肽表征方案与小分子色谱柱表征方案产生的结果进行比较和对比,以评估其必要性。小分子色谱柱数据库非常庞大,扩展的 Tanaka 方案数据库里有近 400 个色谱柱,疏水减法模型内超过 600 个色谱柱。因此,从逻辑上讲,如果存在相关性,则使用较大的数据库来比较色谱柱。通过PQRI数据库[5] 获得Snyder疏水减法模型(HSM)小分子表征数据的网络拓展版[7],ACD数据库中的Tanaka方案以及扩展Tanaka方案的实验结果[3,5,7,13]。肽方案成功表征了38个色谱柱,其中有30个色谱柱,在这三个数据库之间共有(见表1)。将这 30 个色谱柱在三种不同方案上的表征数据合并到一个加载图中,其中观察不同项的位置(图 3)。与间距较大的项相比,位置较近的项突出显示了更大的相关性。
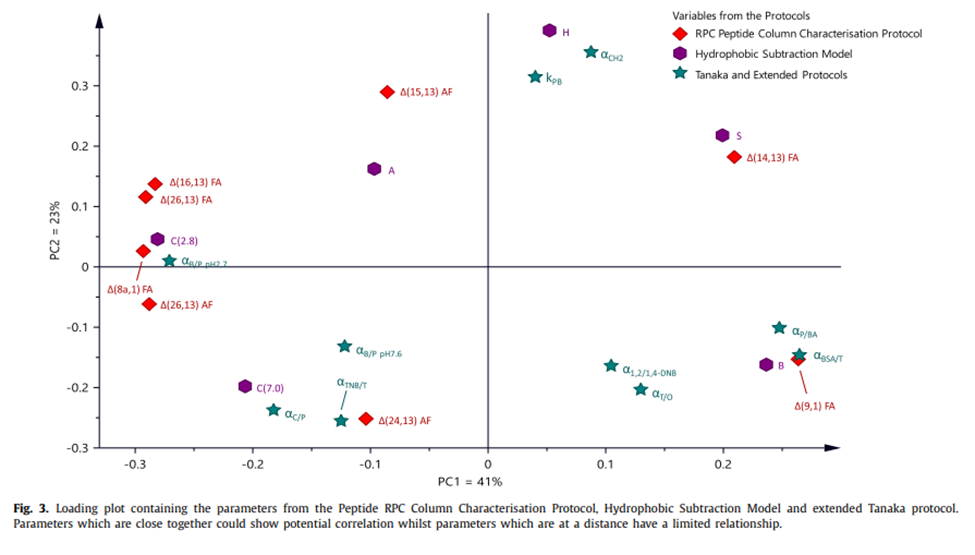
图3
将肽方案的结果与两种小分子方法的结果进行了比较,表明存在一些弱相关性,特别是对于静电类型的相互作用(即Δ(26,13)FA和C(2.8)或α(B/P)pH 2.7和Δ(9,1)FA和αBSA/T,图3)。探针之间的相关性也使用传统的线性回归分析成对比较(表3)。

表3
所得的R2值在0.15 – 0.75和0.32 – 0.73之间变化,在delta值和Tanaka项之间,以及delta值和HSM项之间变化(表3)。Polaris Amide C18在所有三种表征方案中都具有极端的特性,这导致该相与其他相不同。在比较中排除Polaris Amide C18时,回归系数降低,R2值分别在0.10 – 0.45和0.20 – 0.41之间。这是由于配体上带正电荷的官能团具有极端特性,这扭曲了关系分析。结果表明,肽RPC色谱柱表征方案与疏水减法模型或扩展的Tanaka方案之间没有相关性。因此,它证明了需要一种基于肽探针的RPC色谱柱表征方案。
3.4. 方案验证
制备碳酸酐酶和牛胰岛素的胰蛋白酶消化物,以产生可以追踪选择性差异的肽片段。目的是确定肽反相色谱柱表征数据库是否可用于选择具有不同选择性的固定相,从而产生不同的色谱图谱。先前已经证明,该方案可用于查找具有不同和相似选择性的色谱柱,用于不同的目的。然而,相同的肽被用来表征固定相,并说明选择性方面的差异和相似之处[9]。在目前基于牛胰岛素和碳酸酐酶的胰蛋白酶消化物的研究中,使用完全不同的肽进行验证,哪种肽更合适。
Polaris Amide C18、Zorbax 300 SB-C18、Acquity BEH C8、Ascentis Express C18、Kinetex Biphenyl、Acquity CSH C18 和 Acquity CSH Fluoro Phenyl 均通过图 1A 中的score plot图鉴定为差异性大。使用质谱法监测11个碳酸酐酶片段,使用第2.5节中描述的甲酸添加条件,通过提取离子色谱图(EIC)在6个色谱柱上选择离子(图4)。

图4
六根色谱柱之间存在明显的选择性差异,所有六相之间的洗脱顺序以及峰之间的分离度都不同。Ascentis Express C18、Zorbax 300 C18-SB 和 Acquity BEH C8 均被归类为中性相,但均表现出不同的洗脱特征,这表明同一分类中的色谱柱选择性也有不同。对于某些片段观察到的强度差异可以通过未显示的共洗脱片段引起的信号抑制来解释。除了不同的选择性外,Acquity CSH和Polaris Amide C18在甲酸条件下都显示出极好的峰形。
在两种色谱条件(即两种不同的色谱柱或流动相)之间,也可以通过绘制一组化合物的保留时间来得出回归系数(R2)[27,28]来测量选择性。R2 值可以代入方程 (3) 以确定选择性相关性,其中 S 值 0 表示相同的选择性,而值 100 表示正交选择性。
公式3
应用这种方法于酶解片段的保留时间分析,其中图4中的每根色谱柱直接与作为典型的C18色谱柱的Ascentis Express C18进行比较。大于10的结果通常表明两个参数之间存在选择性差异[28]。S值(图4)均大于11,Polaris Amide C18和Ascentis Express C18(S = 33)之间的差异最大,这是相当显著的。
与选择具有不同选择性的固定相同样重要,识别具有相似选择性的色谱柱通常至关重要。以下色谱柱被确定为可能提供与score ploting图相似的选择性特征(图1A);Ascentis Express C18 和 Poroshell HPH-C18、Acquity CSH C18 和 Luna Omega C18 PS,最后是 Kinetex Biphenyl和 Ascentis Express Biphenyl。使用肽表征方案中描述的甲酸梯度条件对碳酸酐酶的胰蛋白酶消化物进行色谱分析(图5)。

图5
Poroshell HPH-C18 和 Ascentis Express C18 在Score Plot图中(图 1A)是叠加的,在图5清楚地展示了肽片段非常相似的洗脱特征,洗脱顺序以及峰之间的分离度极为相似。Ascentis Express Bibenzyl和 Kinetex Bibenzyl在Score Plot图中彼此非常接近(图 1A),两者还含有相似的配体部分。两者洗脱特征非常相似,峰之间有一些细微的差异(参见峰9–11)。最后一对,Luna Omega PS C18 和 Acquity CSH C18,在色谱柱表面具有具有一定程度的正电荷的烷基部分。它们在Score Plot图中的位置(图1A)表明可以预期一些相似性,但也存在一些差异,因为它们的位置没有叠加。图5中的曲线证实了这种情况,整体来说,洗脱特征相似,但一些关键对之间也存在选择性差异。计算选择性相关性,将Poroshell HPH-C18与Ascentis Express C18进行比较,将Ascentis Express Biphenyl与Kinetex Biphenyl进行比较,将Luna Omega PS C18与Acquity CSH C18进行比较。S 值的范围介于 2 和 8 之间,它们都表明预测的相似列对之间存在密切的相关性。
在中pH值下对碳酸酐酶色谱的消化以及牛胰岛素的胰蛋白酶消化观察到类似的选择性差异。总体而言,Score Plot图成功地用于选择具有不同洗脱特征的色谱研究。可用于选择具有相似出峰特征的色谱柱。
04结论
本文将采用肽探针的新型色谱柱表征方案应用于43根色谱柱的研究,其中38根获得了成功。将结果放入数据库中,并使用主成分分析进行评估。色谱柱分成中性、负电/极性或正电特征三类,分类的合理性基于其在分数图中的位置和对相位的先验知识。这种方法可以很容易地识别色谱柱相似或不同,取决于其相对于另一根色谱柱的位置。该方案有助于识别潜在的新型固定相,从而为方法开发策略提供替代选择性。
该研究表明,为肽提供不同选择性和良好峰形的色谱柱通常也具有静电相互作用。特别是,具有某种形式的正电基团的混合模式相显示出巨大的潜力,但需要具有良好的批次间重现性。
将肽反相色谱柱表征方案的结果与两种基于小分子的表征方案进行了比较,确定测试参数之间缺乏相关性。因此体现出基于肽的方案来选择合适的固定相进行肽分离的必要性。
最后,使用胰蛋白酶解物验证了使用固定相肽数据库在低pH值和中等pH值下选择相似和不同色谱选择性的色谱柱。目前正在开展进一步的工作,以扩大该方案的范围,使其也涵盖流动相相关知识。
参考文献:
向上滑动阅览
[1] M.R. Euerby, P. Petersson, Chromatographic classification and comparison of commercially available reversed-phase liquid chromatographic columns using principal component analysis, J. Chromatogr. A. 994 (2003) 13–36.
[2] K. Kimata, K. Iwaguchi, S. Onichi, K. Jinno, R. Eksteen, K. Hosoya, M. Araki, N. Tanaka, Chromatographic characterisation of silica C18 packing materials. Correlation between a preparation method and retention behaviour of stationary phase, J. Chromatogr. Sci. 27 (1989) 721–728. [3] ACD/Labs column selector. 10/07/2019]; Available from: http://www.acdlabs. com/resources/freeware/colsel/index.php.
[4] L.R. Snyder, J.W. Dolan, P.W. Carr, The hydrophobic subtraction model of reversed-phase column selectivity, J. Chromatogr. A. 1060 (2004) 77–116.
[5] U.S. pharmacopeial convention. 10/07/2019]; Available from: http://apps.usp. org/app/USPNF/columnsIntro.html.
[6] A.R. Johnson, C.M. Johnson, D.R. Stoll, M.F. Vitha, Identifying orthogonal and similar reversed phase liquid chromatography stationary phases using the system selectivity cube and the hydrophobic subtraction model, J. Chromatogr. A. 1249 (2012) 62–82.
[7] D. Stoll. HPLC columns - HPLC column selectivity measurements of more than 600 reversed phase columns from over 30 manufacturers. 10/07/2019]; Available from: http://www.hplccolumns.org/about/index.php.
[8] C.T. Mant, R.S. Hodges, Design of peptide standards with the same composition and minimal sequence variation to monitor performance/selectivity of reversed-phase matrices, J. Chromatogr. A. 1230 (2012) 30–40.
[9] J.K. Field, M.R. Euerby, P. Petersson, J. Lau, H. Thøgersen, Investigation into reversed-phase chromatography peptide separation systems part I: development of a protocol for column characterisation, J. Chromatogr. A. 1603 (2019) 113–129.
[10] J.K. Field, M.R. Euerby, P. Petersson, Investigation into reversed-phase chromatography peptide separation systems part II: an evaluation of the robustness of a protocol for column characterisation, J. Chromatogr. A. 1603 (2019) 102–112.
[11] P. Petersson, B.O. Boateng, J.K. Field, M.R. Euerby, A practical approach to modelling of reversed-phase liquid chromatographic separations: advantages, principles and possible pitfalls, LCGC Europe 31 (2018) 120–143.
[12] M.R. Euerby, P. Petersson, W. Campbell, W. Roe, Chromatographic classification and comparison of commercially available reversed-phase liquid chromatographic columns containing phenyl moieties using principal component analysis, J. Chromatogr. A. 1154 (2007) 138–151.
[13] M.R. Euerby, P. Petersson, Chromatographic classification and comparison of commercially available reversed-phase liquid chromatographic columns containing polar embedded groups / amino endcappings using principal component analysis, J. Chromatogr. A. 1088 (2005) 1–15.
[14] J.W. Dolan, A. Maule, D. Bingley, L. Wrisley, C.C. Chan, M. Angod, C. Lunte, R. Krisko, J.M. Winston, B.A. Homeier, D.V. McCalley, L.R. Snyder, Choosing an equivalent replacement column for a reversed-phase liquid chromatographic assay procedure, J. Chromatogr. A. 1057 (2004) 59–74.
[15] N.S. Wilson, M.D. Nelson, J.W. Dolan, L.R. Snyder, R.G. Wolcott, P.W. Carr, Column selectivity in reversed-phase liquid chromatography I. A general quantitative relationship, J. Chromatogr. A. 961 (2002) 171–193.
[16] S. Bocian, A. Felinger, B. Buszewski, Comparison of solvent adsorption on chemically bonded stationary phases in RP-LC, Chromatographia 68 (2008) s19–s26.
[17] S. Bocian, P. Vajda, A. Felinger, B. Buszewski, Solvent excess adsorption on the stationary phases for reversed-phase liquid chromatography with polar functional groups, J. Chromatogr. A. 1204 (2008) 35–41.
[18] S.M. Melnikov, A. Höltzel, A. Seidel-Morgenstern, L. Tallarek, Adsorption of water-acetonitrile mixtures to model silica surfaces, J. Phys. Chem. C. 117 (2013) 6620–6631.
[19] A. Méndez, E. Bosch, M. Rosés, U.D. Neue, Comparison of the acidity of residual silanol groups in several liquid chromatography columns, J. Chromatogr. A. 986 (2003) 33–44.
[20] M. Gilar, K. Berthelette, K. Kalikova, D. Folprechtova, E. Tesarova, B. Alden, Pure mode or mixed mode chromatography? HPLC2019, 2019.
[21] S.M.C. Buckenmaier, D.V. McCalley, M.R. Euerby, Overloading study of bases using polymeric RP-HPLC columns as an aid to rationalisation of overloading on silica-ODS phases, Anal. Chem. 74 (2002) 4672–4681.
[22] S.H. Giese, Y. Ishihama, J. Rappsilber, Peptide retention in hydrophilic strong anion exchange chromatography is driven by charged and aromatic residues, Anal. Chem. 90 (2018) 4635–4640.
[23] P.C. Iraneta, K.F. Wyndham, D.R. McCabe and T.H. Water. A review of waters hybrid particle technology. Part 3. Charged surface hybrid (CSH) technology and its uses in liquid chromatography. 2011 11/07/2019]; Available from: http: //www.waters.com/webassets/cms/library/docs/720003929en.pdf.
[24] L.R. Snyder, J.W. Dolan, High Performance Gradient Elution, John Wiley & Sons, Hoboken, NJ, 2007.
[25] D.V. McCalley, Study of overloading of basic drugs and peptides in reversed-phase high performance liquid chromatography using pH adjustment of weak acid mobile phases suitable for mass spectrometry, J. Chromatogr. A. 1075 (2005) 57–64.
[26] D.V. McCalley, Overload for ionised solutes in reversed-phase high performance liquid chromatography, Anal. Chem. 78 (2006) 2532–2538.
[27] U.D. Neue, J.E. O’Gara, A. Méndez, Selectivity in reversed-phase separations. Influence of the stationary phase, J. Chromatogr. A. 1127 (2006) 161–174.
[28] M.R. Euerby, M. Fever, J. Hulse, M. James, P. Petersson, C. Pipe, Maximisation of selectivity in reversed-phase liquid chromatographic method development strategies, LCGC Europe 29 (2016) 8–21
本篇文章为反相色谱肽分离系统研究第三部分,本研究共有四个部分,将陆续发出,敬请期待!
前期回顾:
1. 反相色谱肽分离系统研究第一部分:开发色谱柱表征方案
2. 反相色谱肽分离系统研究 第二部分:色谱柱表征方案的耐用性评估
ACD/Labs CN
微信号|ACDLabsCN