前段时间,有小伙伴在公众号留言说能不能写点生物药的文章,不要老是小分子药嘛。难道你们团队里只有化学,没有生物?我们团队的生物大咖刘博坐不住了,闪开,我来做个分享,绝对干货!后面还要加卤蛋!(不对,是彩蛋!)
话不多说,直接开始:
1897年Paul Ehrlich 提出的“魔术子弹”( magic bullet) 假说是治疗性抗体药物概念的雏形。从提出这一假说至今,抗体药物的发展已经历了100多年(图1)。
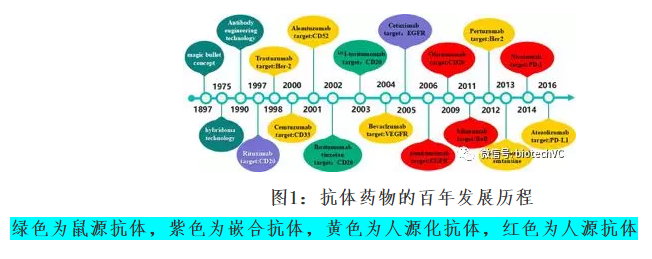
图1:抗体药物的百年发展历程
1986年美国FDA批准了第一个抗体药物Orthoclone OKT3上市,截止目前获FDA批准上市的治疗性单抗新药多达70多个,几百种治疗用抗体处于临床研发阶段。
就目前的统计数据显示,抗体药物的成功率高于小分子化学药物,抗体药物已在肿瘤、自身免疫性疾病领域获得了巨大的成功,目前抗体药物最重要的应用领域为自身免疫性疾病和癌症,随着对疾病机制理解和研究的深入,抗体药物已迅速拓展到眼科、抗感染、心血管等诸多领域。并且其适应症也越来越广,囊括了不同种类的癌症、骨质疏松、多发性硬化症和哮喘等诸多适应症。
治疗性抗体药物发展空间广阔,据相关资料预测到2021年全球治疗性抗体药物的市场能达到3200亿美元的规模,治疗性抗体药物具有巨大的市场容量和空间,对于创新型抗体研发企业,成功开发抗体药物是抗体研发企业的重要目标,同时也是抗体研发人员为之努力的方向。
那么成功的抗体药物开发首先应从哪方面考量呢?大家首先可能会想到的是抗体药物的疗效和副作用。
作为药,未满足的临床需求同样是抗体药物研发企业和人员最初需要考量的一个重要因素,也是治疗性抗体药物研发的始动因素和落脚点,任何创新如果偏离了临床需要都没有太大的价值和意义。
那么我们如何衡量未满足的临床需求?简而言之可以概括为以下2大方面:
(1)针对某种疾病,目前还没有治疗药物;
(2)针对某一疾病的药物,目前疗效还不理想或存在部分患者不可耐受的副作用。
当然这两大方面还可以进一步细化,真正临床需求的确认是需要经过大量的调查和数据分析得出的。抗体药物研发企业在某一方面能够做出真正满足和解决临床需求的差异化的产品,就是巨大的创新,在抗体药物研发和后期的商业化推广中就更可能获得成功。
大家注意,是否是真正的临床需求是需要研发企业充分调研不同医院的一线医生、病人及考察相关的产品、技术、市场等多个维度得出的综合判断。在我们接触的新药研发企业中也发现有的企业根本没有经过上述的访谈、调研和分析,就仅凭个别医生及资料的调查就认定自己开发的产品能满足临床需求解决实际问题,其实这样做出的结论是很不客观和真实的,对于这样的企业我们首先就会打上一个大大的问号。
为什么说这一点很重要,因为对于创新药企包括创新性抗体药物研发企业来说,这是一个方向性问题,涉及到后续的立项策略和靶标选择,如果方向错了就好比我们开车去一个目的地,走错了方向南辕北辙,无论如何都到不了终点,同样对于抗体药物开发来说也很难实现最终的价值,也难以获得成功。
上面分析的以解决未满足的临床需求为目标的抗体药物研发策略属于战略层面的问题,那么如何实现这一目标,做出一些差异化的抗体药物就是战术层面的问题,分析FDA已经批准上市的70多个治疗性抗体药物以及目前处于临床后期研发阶段的几百个抗体药物,我们可以发现这些治疗性抗体药物的研发有两方面的重要变化:
(1)抗体药物的副作用可控,功能及疗效不断改进提升;
(2)单抗药物作用靶标不断扩大已拓展到新的疾病治疗领域和新的适应症。
治疗性抗体药物研发企业可以围绕上述两个方面开发一些能解决和满足实际临床需求的差异化产品,这两方面同样也是剖析抗体药物研发企业及相关产品价值的关键考量因素。
下面我们围绕这两方面并结合具体的实例来具体分析。
抗体药物质量控制贯穿于从抗体药物最初研发到病人使用的全过程,关于抗体全流程的质量控制的文章很多,本文就不再详细阐述。这里我们主要谈谈上面提到的抗体药物研发的两大方面的变化。
我们首先看看第一个方面:影响治疗性抗体药物副作用、功能及疗效的主要因素——治疗性抗体的免疫原性和效应功能,结合具体的实例分析一下。
1、通过削弱抗体药物的免疫原性以提升抗体药物的功能及疗效降低因免疫原性引起的副作用
我们可以通过四种方式降低抗体的免疫原性,消除人抗鼠(HAMA)反应:
(1)抗体人源化和开发人源抗体:可以通过移植鼠抗体的CDR到人抗体的相应部位和正确融合鼠抗体CDR 到人Ig 胚系框架中并建库用相应抗原筛库来实现; 截止2018年11月FDA批准的70多个治疗性抗体新药中全人源化单抗或人源化单抗药物已经成为主流,目前人源单抗的生产技术主要有转基因小鼠技术、抗体库技术、人工设计人源化抗体、EB病毒转化人B细胞、人-人杂交瘤细胞技术等,目前已经上市的全人源抗体中,大部分是通过转基因小鼠获得。
(2)通过分析设计去除抗体上能被人T 细胞识别的表位实现;
(3)通过引入Treg 表位并刺激Treg细胞功能,诱导对异源蛋白的耐受实现;
(4)通过糖基化修饰的改造来实现。
当然抗体药物的免疫原性还和其他一些因素有关,比如说给药途径,给药的频率,用药时间的长短以及病人自身免疫系统的状态,抗体药物生产过程中的问题,比如说杂质、聚体或其它污染物等。
因此抗体药物不光是在研发阶段,在抗体药物上市以后的使用过程中都需要严密的监测。对于抗体人源化的过程中需要我们充分考虑影响抗体稳定性及成药性的多种因素作出综合设计分析,从全局进行把控。在抗体药物研发进程中尽可能早的发现和去除影响抗体药物ADA的因素,尤其是抗体序列和结构上可能影响抗体药物ADA的因素,尽可能避免到抗体药物研发的较后期发现ADA而造成重大的损失
2、通过增强抗体的稳定性及效应功能以提升抗体药物的功能和疗效
目前FDA批准的抗体药物大都以IgG抗体为主,本节我们以传统的IgG抗体结构以及具体抗体药物的例子来分析增强抗体效应功能的策略。目前上市的以传统IgG结构为基础的治疗性抗体可以通过优化和改造Fab及Fc片段来增强抗体药物的稳定性及效应功能(图2)。
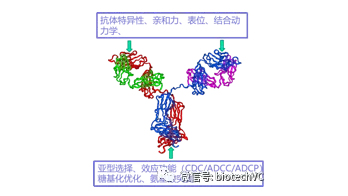
图2增强抗体药物效应的方法
2.1抗体Fab片段的优化
抗体Fab片段的CDR区参与了抗体与抗原的结合,通过与抗原结合发挥抗体的效应功能,抗体结合抗原以后可以阻断或中和靶分子的生物学功能,或与细胞膜表面分子结合引起细胞内信号通路的变化诱导细胞凋亡或抑制细胞增殖;通过结合靶标抗原调节人体的自身免疫系统或激活免疫细胞。
对抗体Fab片段CDR区域及框架区的优化可以提高抗体特异性、亲和力及结合动力学的特性进而增强抗体的稳定性及效应功能。下边我们看几个例子:
(1)通过优化奥马珠单抗(omalizumab)CDR残基提高抗体亲和力以增强体内效力
普特南等人研究了高亲和力抗IgE抗体-1(HAE1),该抗体是FDA批准的奥马珠单抗的高亲和力版本。HAE1与奥马珠单抗IgG1框架相同但CDR序列不同,其中9个CDR残基的变化使HAE1的koff降低约22倍,并且对IgE的结合亲和力提高约23倍。食蟹猴PK / PD研究中,HAE1只需要较低的浓度来抑制游离血清IgG水平,这表明HAE1的较高亲和力可能转化为更高的体内效力。
(2)优化帕利珠单抗增加kon来提高亲和力可以改善单抗IgG形式的病毒中和作用
帕利珠单抗(Palivizumab,商品名Synagis)是靶向呼吸道合胞病毒的人源化单抗,属于儿科领域的“重磅药”。帕利珠单抗可通过结合病毒表面上的RSV融合蛋白而阻断膜融合过程,也可以阻止被RSV感染的细胞间的融合过程,该抗体药物主要用于预防小儿呼吸道合胞病毒(RSV)感染。Wu等人应用定向进化方法来改善帕利珠单抗与RSV F蛋白的结合率(kon)和解离率(koff),并发现通过增加kon来提高亲和力可以改善单抗IgG形式的病毒中和作用,但是在提高抗体亲和力的同时需要同时充分考虑抗体的PK特性和组织的生物利用度。
那么抗体药物来说亲和力是不是越高越好呢?
对于抗体的亲和力我们需要辩证地去看,对于作用于不同靶标的抗体我们需要有区别的去分析判断,对于抗体药物来说其亲和力并不是越高越好,亲和力提高有可能提高抗体的疗效但同时也面临导致副作用增大的风险,当然抗体的亲和力降低,副作用可能会降低,但药效可能下降。
因此我们优化抗体亲和力的时候,需要兼顾到副作用和疗效,根据不同的作用靶点以及靶点在不同组织器官的表达情况确定抗体药物适合的亲和力,找到副作用及疗效的平衡点。
例如靶向EGFR 家族的抗肿瘤抗体药物可细分为靶向表皮生长因子受体EGFR的抗肿瘤抗体药物,靶向HER-2 的抗肿瘤抗体药物,靶向血管内皮生长因子VEGF/VEGFR 的抗肿瘤抗体药物。
其中以表皮生长因子受体EGFR为靶点的单抗药物已上市的有Cetuximab(西妥昔单抗)、panitumumab(帕尼单抗)和尼妥珠单抗(泰欣生,Nimotuzumab),它们用于治疗转移性结肠癌和头颈部肿瘤,通过阻断EGFR 信号通路发挥作用。
在Cetuximab(西妥昔单抗) 和panitumumab(帕尼单抗)治疗中,最常见的不良反应是皮肤反应(如过性痤疮样皮疹)和低镁血症(EGFR在肾髓袢中高表达),帕尼单抗的Kd为5×10-11(M),因此皮肤副作用相对较大,尼妥珠单抗(泰欣生,Nimotuzumab)的Kd约为2×10-8,皮肤的副作用较低。
靶向HER-2 的主要抗体药物为trastuzumab(曲妥珠单抗),通过阻断HER2 相关信号通路起作用,主要用于治疗乳腺癌和胃食道癌。此类药物常见副反应有心脏毒性、心力衰竭,有时有严重过敏反应,输液反应和肺中毒等,对于此类靶点的抗体亲和力同样不能太高,因此抗体亲和力的优化是需要我们在充分考虑成药性的前提下进行的。
抗体Fc区域的糖基化改造
单抗Asn297处的糖基化模式调节了抗体Fc结构域与Fc受体结合的构象状态。 这些N-聚糖对FcγR结合位点的结构完整性至关重要,已经证明糖基化的去除消除了FcγR亲和力和补体结合/效应功能。目前已经证实减少岩藻糖和唾液酸基团并增加二等分N-乙酰葡糖胺,半乳糖和甘露糖可增强Fc介导的ADCC和CDC效应。
下面我们来看几个临床上成功的例子。
mogamulizumab是一种靶向CC趋化因子受体4型(CCR4)的人源化单克隆抗体,被FDA批准用于复发或难治性CCR4阳性T细胞白血病或淋巴瘤的患者的治疗。obinutuzumab(GA101,Gazyva),是一种含有N-乙酰葡糖胺的非岩藻糖基化抗CD20单抗药物,Obinutuzumab于2013年被批准用于治疗先前未治疗的慢性淋巴细胞白血病(CLL)患者。
与第一代产品利妥昔单抗(美罗华)相比,第二代产品obinutuzumab去除了50%的盐藻糖修饰并包含二等分N-乙酰葡糖胺,对人FcγRIII的亲和力较第一代产品高50倍,其对表达CD20的淋巴瘤细胞系的ADCC效应增加了10-100倍,在临床上也体现了治疗的优越性。
目前国内天广实开发了第3代产品MIL62,MIL62是利妥昔单抗(美罗华)与阿托珠单抗(GA101)的优效产品(me-better)。MIL62是100%岩藻糖敲除的第三代CD20抗体,目前体外药效学证明有效于进口产品美罗华。
第三个例子是benralizumab(Fasenra),该抗体是人源化的非岩藻糖基化的抗IL-5Rα抗体,其介导与表达IL-5Rα的嗜酸性粒细胞的ADCC消耗效应显著,所述嗜酸性粒细胞涉及哮喘急性发作。Reed等人通过临床研究发现通过单次静脉注射benralizumab(MEDI-563)就可以导致轻度哮喘患者嗜酸性粒细胞的强烈消耗,效果可以持续8-12周。
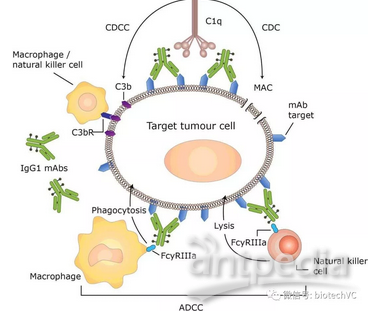
抗体Fc区域的氨基酸突变改造
通过于抗体Fc结构域中引入氨基酸的点突变可以增强抗体Fc效应功能。该方法不仅仅限于对FcγRIII的改变,还允许突变Fc结构域中与多个活化FcγR有关的区域。
一系列已上市治疗性单抗药物(利妥昔单抗,西妥昔单抗,曲妥珠单抗和阿仑单抗)的Fc区域的突变体显示出FcγRIIIA亲和力的增加及FcγRIIB亲和力的降低,这些抗体Fc区域的双突变体(Ser239Asp / Ile332Glu)和三联突变体(Ser239Asp / Ile332Glu / Ala330Leu)增强了ADCC活性。 这些突变体在临床前体外实验中显示出2个数量级的体外效应功能增强,能够作用于表达低水平靶抗原的细胞,并在体内临床前模型中显示出细胞毒性效力的增强,当然这些突变体的临床疗效还需要进一步证实。
几项临床前研究同样也表明Fc蛋白工程化单克隆抗体对癌症和病毒的体内活性增强,目前这些单克隆抗体已进入临床开发阶段,例如治疗白血病的CD19抗体 Xmab5574(MOR00208),用于治疗乳腺癌的HER2抗体margetuximab。
此外我们还可以突变抗体Fc片段的Gly236Ala以增强抗体药物的ADCP活性,其选择性地增强对FcγRIIA的亲和力,通过Gly236Ala突变(巨噬细胞介导的ADCP和NK细胞介导的ADCC)以及Ser239Asp / Ile332Glu双突变的联合(ADCC增强)进一步增强抗体的效应功能。
此外,位于上铰链区的突变可以增强与C1q的结合以增强抗体的CDC活性。其他位置的点突变,如CH2结构域中的Lys326Trp和Glu333Ala,已被证明可以增强CDC效应。 双突变体,如Lys326Trp / Glu333Ala,Lys326Ala / Glu333Ala和Lys326Met / Glu333Ser,以及三重突变体,如Ser267Glu / His268Phe / Ser324Thr,与单个突变相比,其抗体的CDC效应进一步增加。
设计新功能抗体
新功能抗体药物是当前及未来抗体药物开发的一个重要方向,通过开发新功能抗体来提高抗体药物的疗效,新功能抗体主要有抗体偶联药物(ADC),双特异性抗体,纳米抗体,Fab片段,ScFv结构的抗体,抗体融合蛋白等。这些抗体的特点和优势大家从很多公开资料中都能了解,这里就不再详细阐述。简而言之,开发这些抗体的最终目的还是希望提高抗体药物的效应功能,使抗体药物的临床疗效提升或副作用改善从而实现较已有药物差异化的竞争优势。
为了实现上述目标,我们应从哪些方面去努力呢?总的来看有两个重要的方面:
(1)首先应该进行详细和充分的文献、ZL调研,仔细分析研究目标抗体及对应靶标涉及到的全部文献及ZL材料,例如目前针对这一抗体及作用靶点已经开展了哪些研究,哪些方面是未研究的,为什么没有相关的研究,在针对该靶点的抗体药物设计方面哪些是可以近一步改进和提高的,以及这些改进和提高对于提高临床疗效及减少副作用的关系有多大,对于以上方面的理解深度将会影响抗体药物的后续开发,要出色的完成上述工作对于相关人员的知识储备和经验的积累也具有很高的要求;
(2)要求抗体药物研发人员对抗体整体及各部分的结构功能有很深的理解,此外还需要对不同类型的IgG抗体的结构有清晰的认识,清楚的明白关键结构域中每一个氨基酸的变化对于抗体结构和功能的影响,并能综合运用现有的各种方法手段进行分析验证。在上述基础上用多种不同的体内外模型对相关设计进行多次重复验证,此外抗体各部分连接的氨基酸也很重要,连接linker的稳定性,连接序列的刚性及柔性的组合策略,不同氨基酸的搭配组合,充分考虑所用氨基酸的电荷性质等等。做到上述这些方面,往往会使我们设计的抗体在疗效上体现出一个意想不到的提升效果。
以上我们用较大的篇幅分析了抗体药物研发的第一方面的重要变化:抗体药物的副作用及功能和疗效的提升方面。
下边我们看看文章开篇提到的第二个方面:单抗药物作用靶标不断扩大已拓展到新的疾病治疗领域和新的适应症。
抗体药物的靶标可以分为已经成药的靶标和未成药的靶标,对于已经成药的靶点来说,由于有大量的科学和临床研究,而且有已经上市的药物,对于作用于这类靶点的抗体,临床开发研究的风险较小,我们可以认为靶标的生物学风险基本已经去除,但对于开发针对此类靶点的抗体药物来说,后期商业化的风险较大。对于抗体研发企业来说能否开发出具有比较优势的差异化产品至关重要,这个差异化主要体现临床疗效的提升和副作用的降低方面,这也就回到了我们第一部分探讨的内容上。
对于未成药的靶标而言还可以细分为两大类。
(1)一类靶标相对比较成熟,目前有大量的基础及临床相关的研究,有较多的人类循证医学的证据,目前已经有该靶点的抗体进入临床研究,这样的靶标虽然较有上市药物的成熟靶点的临床开发风险大,但是一旦开发成功,应该具有较大的商业价值。
(2)另一类靶标就是目前虽然有一些基础研究,但是临床和人类循证医学研究很少,目前也没有进入临床阶段的抗体,对于这样的靶标,临床开发风险极高,对于这样的靶点很多的时候还是保持一种跟踪的态度,在概念验证上作一些初步工作,对相关靶点的研究密切关注,如有重大突破就可以快速跟进。大家可能会问对于抗体药物的全新靶点(还未报到的靶点)我们是怎么发现的呢,我们可以通过分子流行病学调查,人类遗传学研究,人类功能基因组学、蛋白组学研究,生物信息学、药理学、模式动物研究,人类循证医学研究去发现。
总之,抗体药物的开发必须以临床需求为核心,解决还未满足的临床需求,不断开发新的靶点和适应症。对于初创型的抗体药物研发企业,需要有清晰的自我定位和目标,在抗体作用的靶标上选择好,可以兼顾不同类型靶点的一个搭配组合,确立好了相关的靶点后就需要在提升抗体药物功能和疗效上下功夫,特别是针对本文分析的抗体药物免疫源性及抗体药物副作用及效应功能,通过这些努力以提高抗体药物的临床疗效,要实现这些还需要抗体研发人员对于抗体药物的结构和功能的关系有深入的了解,需要抗体研发企业有较深的积累沉淀。
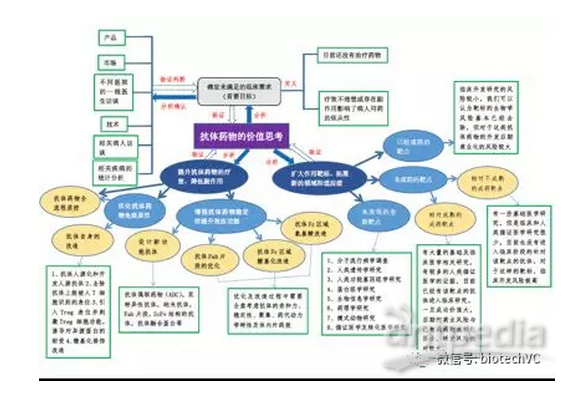
为了大家清理理解本文的思路和阐述的逻辑,特配思维导图一张供大家参考
参考文献:
Leipold D, Prabhu S. Pharmacokinetic and pharmacodynamic considerations in the design of therapeutic antibodies.Clin Transl Sci. 2018 Nov 10.
Chan AC Carter PJ. Therapeutic antibodies for autoimmunity and inflammation.Nat Rev Immunol,2010,10( 5) : 301-316.
Weiner L M,Surana R,Wang S.Monoclonal antibodies:Versatile platforms for cancer immunotherapy.Nat Rev Immunol,2010,10( 5) : 317-327.
Kozlowski S, Swann P Current and future issues in the manufacturing and development of monoclonal antibodies.Adv Drug Deliv Rev,2006,58( 5-6) : 707-722.