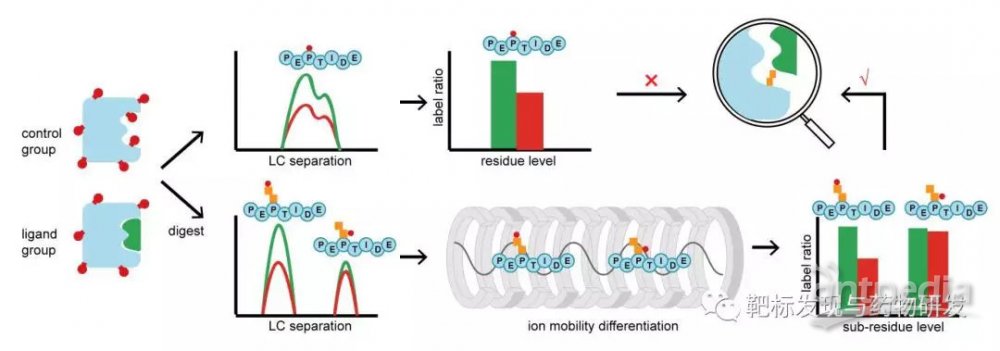
近日,中国药科大学郝海平、叶慧团队在Analytical Chemistry杂志上发表题为“Sub-residue Resolution Footprinting of Ligand-Protein Interactions by Carbene Chemistry and Ion Mobility-MassSpectrometry”的研究文章。该文章开发了结合卡宾足迹法(carbene footprinting)与离子淌度质谱(Ion Mobility-Mass Spectrometry,IM-MS),将蛋白配体互作区域的结构表征研究提高到亚残基水平的空间分辨率的技术。
该研究着眼于蛋白质与配体相互作用这一生命中的基本过程,致力于表征蛋白质-小分子复合物的结合位点,为理解蛋白质受小分子调控的结构变化,并基于靶点蛋白进行药物设计和优化的研究奠定结构基础。与经典的生物物理结构分析技术相比,采用质谱技术可以在短时间内完成对微量蛋白的高级结构分析,并表征其蛋白-配体互作区域。基于此优势,一系列的蛋白结构质谱(structural MS)策略被开发出来。传统策略如化学修饰或交联(cross-linking)手段等仅针对特定的氨基酸残基进行反应,因此很多不能参与反应的残基的位置信息无法获得。因此,该研究聚集近年来新兴的蛋白印迹技术,例如蛋白质的快速光化学氧化(fast photochemicaloxidation of proteins,FPOP),卡宾足迹(carbene footprinting)等方法,利用自由基的高反应活性,将自由基插入到氨基酸残基侧链的C-H、N-H、O-H、S-H键中,形成稳定的质量迁移供质谱识别,并根据标记程度的变化确定配体结合位点。但该方法仍存在局限,其分辨率仅停留在氨基酸水平,难以和经典的结构表征技术进行匹配。
离子淌度质谱(IM-MS)可根据气态离子在质量,电荷和形状上的差异来分离气态离子,具有解析结构异构体的独特潜力。因此,对由于自由基插入同一个氨基酸残基不同位置形成的异构体,可以利用离子淌度进行检测与区分,使得在亚残基水平上对蛋白与配体结合的结构表征成为可能。
文章首先对模型蛋白溶菌酶与其配体NAG4考察亚残基水平印迹法的可行性进行考察。利用经典的氨基酸水平分析可以获取溶菌酶与NAG4的结合位点信息。
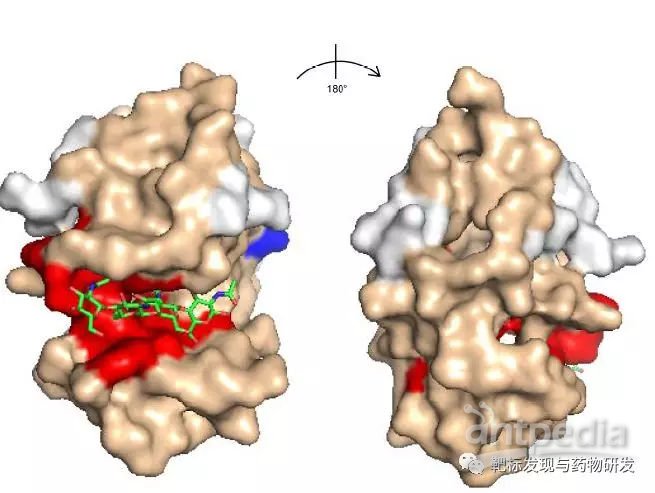
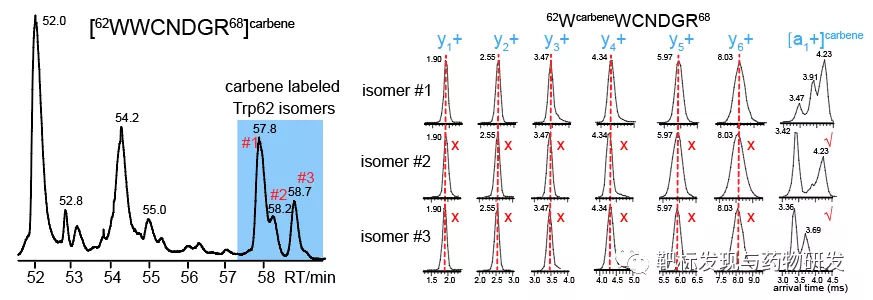
进一步分析发现,Trp62位点在NAG4结合后,标记比例下降最为明显,并且由于卡宾插入到不同Trp62侧链位置上,在色谱上展现出三个峰,其二级谱图基本相同,难以用经典的shotgun质谱手段对异构体(isomers)进行解析。而利用淌度对Trp62 isomers碎片离子进行分析后发现,不含有卡宾修饰的碎片离子在抵达时间(arrival time)上一致,而带有卡宾修饰的碎片离子有不同的抵达时间,意味着3个Trp62 isomers结构不同。因此,利用淌度质谱对isomers进行定量,可以提供比氨基酸水平定量更精细的信息。
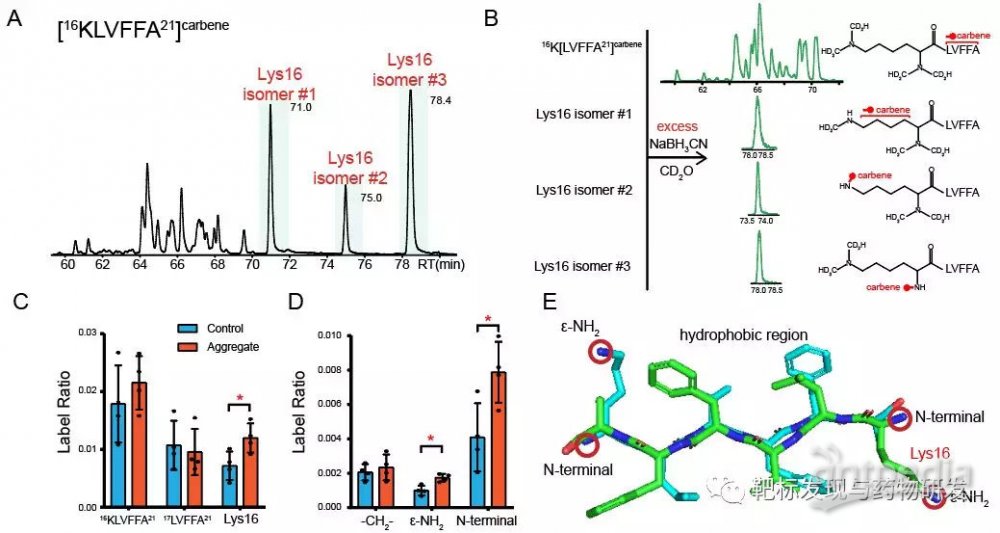
接着,文章试图对isomers具体结构进行确证。通过对Aβ的药效片段在自由与聚集状态下进行标记,可以发现作为药物结合位点的Lys16残基在标记后在色谱上有三个峰。将三个isomers用制备色谱进行分离,对一级氨基进行修饰后,可以确证三个isomers分别对应着卡宾修饰在C-H,ε-NH2,N-terminal三种位置的结构。并且,在游离与聚集状态下的Lys16的亚残基水平上的标记水平变化与结晶获得的结构变化相吻合。
最后,文章在雌激素相关受体ERRα上表征了该蛋白靶点与反向激动剂compound 1a, 激动剂DK3、内源性配体cholesterol的相互作用的位点。基于亚残基印迹法的淌度质谱数据发现,各个配体与靶蛋白的结合域的Phe399位点被卡宾标记产生的位置isomers有不同的可及性变化趋势,这提示三种配体在靶蛋白的Phe399位点有不同程度的结合状态,这可能导致配体对靶点发挥不同的激活/抑制效果。进一步将淌度实测得的碰撞横截面积值(collision cross section, CCS)与预测值相比对,可以初步推断出卡宾分别标记在Phe399侧链苯环上的meta,ortho,para位置。
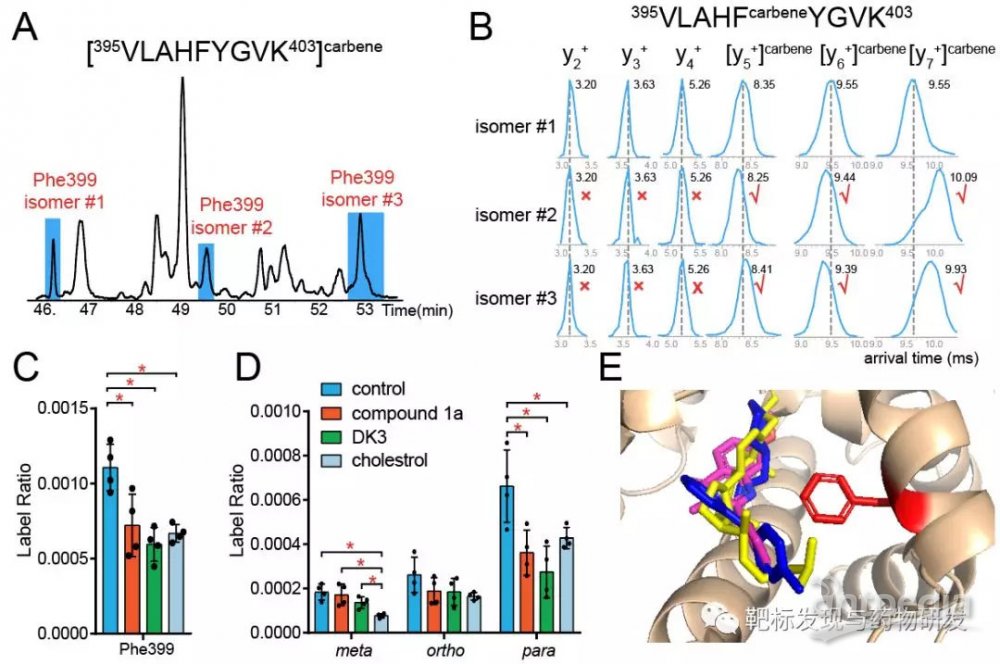
全文总结,文章利用卡宾足迹法与离子淌度质谱进一步提高了结构质谱技术的分辨率到亚残基水平,随着色谱与更高分辨的淌度技术的分离性能的逐步提高,研究预期该方法在蛋白高级结构研究和药物研发领域将有更广阔的应用前景。
[1] Lu, Gaoyuan, et al. " Sub-residue ResolutionFootprinting of Ligand-Protein Interactions by Carbene Chemistry and IonMobility-Mass Spectrometry " Analytical chemistry (2019).
[2] Manzi, Lucio, et al. "Carbenefootprinting accurately maps binding sites in protein–ligand and protein–proteininteractions." Nature communications 7 (2016): 13288.
[3] Wang, Liwen, and Mark R. Chance."Protein footprinting comes of age: mass spectrometry for biophysicalstructure assessment." Molecular & Cellular Proteomics 16.5 (2017):706-716.
[4] Jia, Chenxi, et al. "Site-specificcharacterization of D-amino acid containing peptide epimers by ion mobilityspectrometry." Analytical chemistry 86.6 (2014): 2972-2981.
[5] Li, Gongyu, Daniel G. Delafield, andLingjun Li. "Improved structural elucidation of peptide isomers and theirreceptors using advanced ion mobility-mass spectrometry." TrAC Trends in Analytical Chemistry (2019).