
Aimmune Therapeutics是一家专注于开发创新疗法治疗潜在危及生命的食物过敏症的生物制药公司。近日,该公司宣布,美国食品和药物管理局(FDA)已批准花生过敏免疫疗法Palforzia(花生过敏原粉剂-dnfp,开发代码:AR101)。值得一提的是,Palforzia是全球首个获批用于治疗花生过敏的疗法,同时也是全球首个获批用于治疗任何食物过敏的疗法。此前,FDA已授予该药治疗花生过敏的快速通道资格和突破性药物资格。
花生过敏是全球最常见的食物过敏之一,仅在美国,就有超过160万儿童和青少年对花生过敏。一直以来,针对花生过敏儿童和青少年的标准护理都是严格的花生排除饮食(elimination diet),以及在意外摄入花生引起过敏反应时及时给予救援药物。尽管保持高警惕性,但仍可能发生意外摄入花生,导致严重程度不可预测的过敏反应,以及导致严重过敏反应的终身风险。
Palforzia是一种口服免疫疗法(OIT),用于确诊为花生过敏的患者,减轻意外摄入花生后可能发生的过敏反应,包括严重过敏反应。Palforzia可在4-17岁儿童和青少年患者中启动治疗和维持治疗,在达到18岁时应继续服用,除非医生另有指示。Palforzia将与花生避免(peanut-avoidant)饮食结合使用,即服用该药的患者应避免饮食中有花生。需要指出的是,该药不适用于花生过敏反应(包括严重过敏反应)的紧急治疗,在花生过敏期间也不应服用。

花生过敏是一个价值30亿美元的市场。作为首个治疗花生过敏的药物,业界对Palforzia的商业前景非常看好。医药市场调研机构EvaluatePharma此前预测,Palforzia在2024年的销售额有望达到17.5亿美元。
Palforzia是采用Aimmune公司专有的口服脱敏免疫疗法(CODIT)治疗平台开发的首个产品,该平台旨在利用明确的、精确数量的关键过敏原使患者脱敏,从而针对因意外摄入食物过敏原所致的免疫反应提供有意义的保护水平。
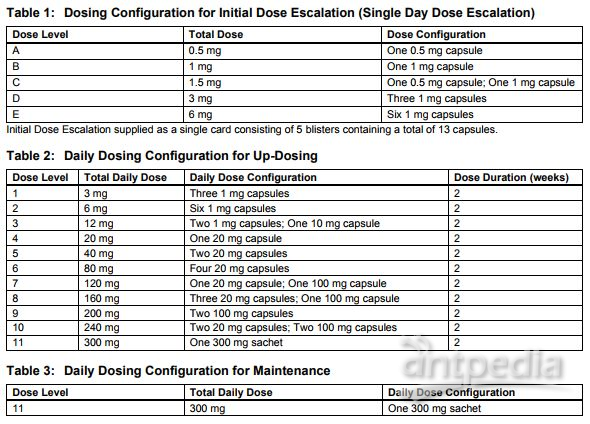
Palforzia由从花生中提取的关键过敏原组成、是一种成分固定的粉末,包装于可拉开的彩色编码胶囊中(用于剂量递增和加药)和小袋(300mg/袋,用于维持治疗)。用药时,将粉末从胶囊或小袋中取出,与少量半固体食物(如苹果酱、酸奶或布丁)混合,然后食用。
Palforzia治疗分为三个阶段:单天剂量递增阶段、加药阶段、维持治疗阶段。每个阶段用药详见下表:
Palforzia的生物制品许可申请(BLA)纳入了7项临床研究的疗效和安全性数据,包括2项关键性III期PALISADE和RAMSES临床试验、II期ARC001和ARC002开放标签随访研究,以及正在进行的ARC004、ARC008、ARC011得数据。
Palforzia的有效性由一项随机、双盲、安慰剂对照临床试验支持,该试验在美国、加拿大、欧洲开展,涉及约500例花生过敏个体。通过评估受试者在接受6个月的维持治疗后,单次服用600毫克花生蛋白(是Palforzia每日维持剂量的2倍)且不发生超过轻度过敏症状的情况下耐受口服挑战的受试者百分比来评估疗效。结果显示,Palforzia组有67.2%的受试者在口服挑战中耐受600毫克剂量的花生蛋白,而安慰剂组的受试者耐受比例仅为4.0%。
Palforzia的安全性在两项双盲、安慰剂对照临床研究中进行了评估,涉及约700例花生过敏个体。研究中,Palforzia最常见的副作用为腹痛、呕吐、恶心、口腔刺痛、瘙痒(包括口腔和耳部)、咳嗽、流鼻涕、喉咙不适和发紧、荨麻疹、喘息、呼吸急促和过敏反应。Palforzia不应用于伴有不受控哮喘的个体。