高效液相色谱(HPLC)是一种进行物质分离、鉴定和定量的分析方法。与其它通常采用梯度模式的各种生物聚合物HPLC(离子交换、疏水相互作用和反相色谱)不同,SEC(尺寸排阻色谱法)通常采用等度方法。
尺寸排阻色谱法
尺寸排阻色谱法(SEC)包括凝胶渗透色谱法(GPC)和凝胶过滤色谱法(在含水条件下实行的一种特殊SEC法),是利用球形颗粒多孔基质作为固定相的一种分析方法。小分子能够渗透到筛孔中并被截留。与此相反,大分子则不能进入筛孔,只能以线性流速通过色谱柱。因此,分子根据其大小进行分离,大分子先从色谱柱中洗脱出来,而后才是小分子从色谱柱中洗脱出来。
SEC是一种常用于生物聚合物的分离方法。目前的应用领域如下:

图1 免疫球蛋白G(IgG抗体;图片由Sartorius提供)
测定分子量,例如抗体(免疫球蛋白G,(见图1),肽和蛋白质)
作为一个研究构象变化的工具用于下游加工(后续加工和产品净化)。
特殊应用:用于肽和蛋白质混合物的自动化样品制备的SEC限制介入色谱柱。
几十年来,生物制药在医药市场上已经占据了重要地位。在这些生物制药产品中,有医药用酶、凝血因子、各种激素——如胰岛素、依泊汀或生长激素、单克隆抗体(mAbs)和生物工程疫苗。
SEC分析是下游加工中的标准方法,用于通过重组生产治疗性蛋白质和抗体来确定生物制造期间靶分子的纯度和聚集状态。
确定分子量间的差异来检测污染物和聚合物是基于高纯洗脱液的使用,高纯洗脱液不会与固相发生任何反应。
SEC所需特殊质量的水可以从各个制造商处购买,或者直接使用arium®pro VF等实验室纯化水系统在现场按需直接制备。
水的实验评估
本文对重组单克隆抗体进行了定性研究,作为SEC分析使用的一个例子。所使用的解决方案源于我们的内部方案。
在上游加工(溶液制备)期间,发酵培养基(宿主细胞DNA、宿主细胞蛋白质、培养基成分,如白蛋白、胰岛素和转铁蛋白)以及微生物和内毒素产生的杂质和污染物必须在下游加工中减少。这一过程也是杂质的来源(蛋白酶的加入,蛋白A的泄漏)。mAb产物本身也能形成杂质,例如分裂的或聚集的抗体,mAb的脱酰胺或氧化形式或错误折叠分子,对此必须进行检测。
对于靶蛋白纯度的质量控制,根据其分子量分离,采用SEC等方法来检测聚集的抗体。
实行初步测试来检测这些操作中使用的超纯水是否适合用于SEC分析。如[原位杂交 - 超纯水对RNA技术的重要性]中所述制备超纯水,并将其用于这些初步试验和进一步确定单克隆抗体聚集状态的测试。

图 2 当前的arium®pro VF超纯水系统(照片由Sartorius提供)
初步试验旨在说明arium® pro VF(上一代型号,同图2所示当前系统生产超纯水的技术规格相同)是否可以用于SEC分析,检测单克隆抗体的聚合物和单体。此外,测试了多种缓冲物质的作用。
在测试系列中采用了以下物材料(见表1):

所使用的色谱柱是Phenomenex Yarra SEC 3000 (3 μm),是用改性硅填充的SEC色谱柱。新一代超纯硅胶的改性确保了最低限度的蛋白质吸附,这对于实现高效的回收率和可靠的定量分析至关重要。Yarra色谱柱使用了孔径为290 Å的填料,从而使天然蛋白质的线性范围在5 kDa和700 kDa之间。
在加入或不加入缓冲物质的情况下来确定超纯水的纯度。加入的缓冲物质如下所示:
TE缓冲液= 1% 1 M Tris-(羟甲基) - 氨基甲烷(TRIS),0.2% 0.5M乙二胺四乙酸(EDTA),0.01%十二烷基硫酸钠(SDS),pH 8,电导率1.4 mS/cm
Citrate = 20 mM citric acid monohydrate, pH 3.6, conductivity 1.7 mS/cm
柠檬酸盐= 20 mM 一水柠檬酸,pH 3.6,电导率1.7 mS/cm
磷酸钠/硫酸钠= 0.1M 磷酸钠/硫酸钠,pH 6.6,电导率23mS/cm,以及arium® ultrapure water without any buffer additives, for use as a controlarium®超纯水,不添加任何缓冲添加剂,用于对照。
SEC的分析色谱图如图3所示,同时也显示使用的超纯水与固定相之间没有任何相互作用。流动相中加入0.1 M磷酸钠/硫酸钠后,同样显示一条没有峰值的直线基线。与此相反,柠檬酸和TE的增加表明了存在与色谱柱基质产生作用的污染物或物质(图中峰值部分),并因此能扭曲真实的色谱图。
试运行的结果表明,arium®VF超纯水可用于制备洗脱液的缓冲物质的溶剂,然后对样品进行实际分析。
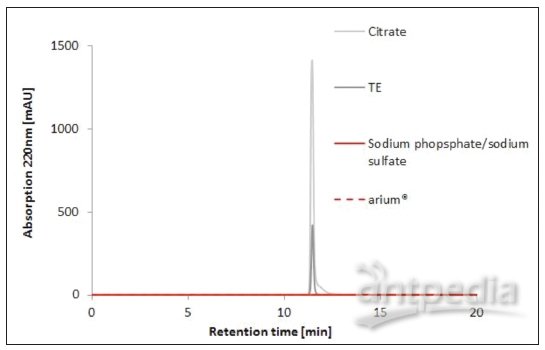
图 3 各种缓冲液和arium®pro VF超纯水的HPLC-SEC分析。流动相:0.1 M磷酸钠/硫酸钠,pH 6.6,电导率23 mS/cm,在超纯水中(表2中所述条件)。
为了在SEC分析中获得可重现的结果,必须使用新鲜制备的洗脱液。对于待分析的样品,需要优化洗脱液的pH和离子强度。在保存色谱柱前,应先用洗脱液冲洗,然后用含0.05%叠氮化钠的超纯水冲洗,并在此条件下进行保存。
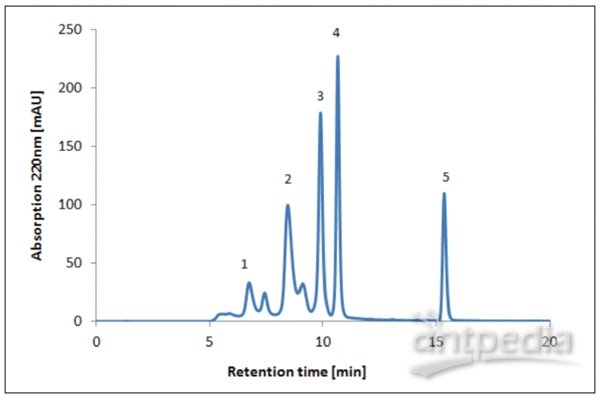
图4 蛋白质混合物(标准蛋白质)的HPLC-SEC分析(条件列于表2中)。
色谱柱用的流动相(0.1 M磷酸钠/0.1M硫酸钠,pH 6.6,电导率23 mS/cm)用超纯水制备(超纯水的原电导率为0.055 μS/cm或18.2 MΩ(兆欧姆),补偿至25 °C)。SEC-HPLC使用表2中列出的设置/参数操作。为了防止细菌生长,使用含0.05%叠氮化物溶液的超纯水来清洗和储存色谱柱。为了制备用于HPLC-SEC操作的两种溶液,使用Sartolab BT 500 Bottle Top 0.2 μm真空过滤装置来过滤脱气。通过Sartorius Minisart® RC4(17821,0.2 μm)预先过滤并将其填充在小瓶(WICOM WIC 42000)中来制备要注射的样品。
单克隆抗体聚集状态确定的测试程序和结果
色谱柱和预置柱用流动相以1 mL/min的速度进行洗涤,直到达到稳定的基线。UV检测器测量样品在220,260和280 nm波长的吸光度(单位为毫安吸光度(mAU))。使用已知分子尺寸的蛋白质检查色谱柱的性能(见图4和表3)。

标准曲线可根据标准蛋白的对数分子大小和确定的截留时间进行绘制。利用这条曲线可以用根据截留时间来计算未知样本。
色谱柱的性能可使用标准蛋白质混合物进行定期检查。该性能受洗脱液中添加剂的纯度、洗脱液与色谱柱基质的相互作用以及所分析样品组分的影响。所使用的缓冲液可能与固定相之间完全不起任何相互作用。
SEC分析可用于质量控制,也可用于纯化工艺的优化和开发。
下文说明了在下游工艺过程中记录的SEC色谱图。单克隆抗体在一系列连续的步骤中被纯化。首先实行细胞收获、澄清和浓缩步骤,然后实行捕获步骤(蛋白A亲和层析)。然后,实行中间步骤除去污染物(例如阳离子交换剂),然后实行抛光步骤即完成(阴离子交换剂)。随后,进行病毒过滤和最终超滤。
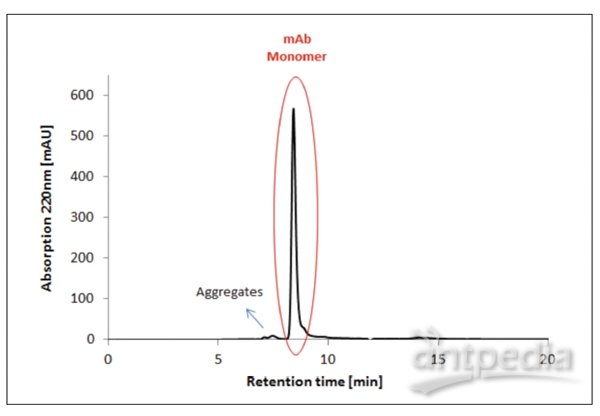
图5 细胞收获后的单克隆抗体的HPLC-SEC分析和下游加工期间的初步澄清(条件列于表2中)。
为了确定抗体的纯度,在下游加工期间在SEC色谱柱中运行样品。在细胞收获(图5)和蛋白质A亲和层析(图6)的初步澄清后,样品运行的色谱图如下所示:
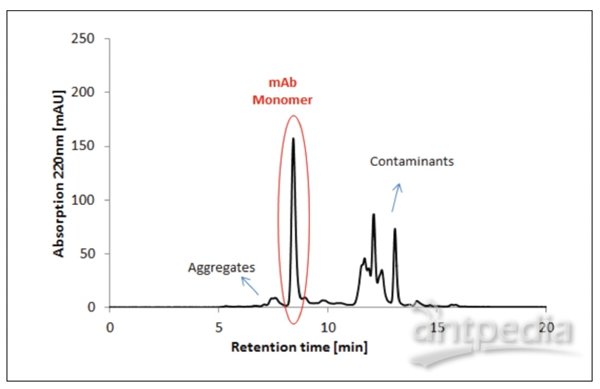
图6 蛋白质A亲和层析后的单克隆抗体的HPLC-SEC分析和下游加工期间的初步澄清(条件列于表2中)。
细胞收获(图5)的初步澄清后的HPLC分析运行显示了许多污染物,如宿主细胞DNA、宿主细胞蛋白质、内毒素、培养基组分和抗体产物本身引起的杂质以及聚合物,这些污染物需要在随后的下游加工步骤中去除。
在下面的步骤中,使用了蛋白质A对免疫球蛋白G(IgG)的特殊亲和性。在该步骤中使用了Sartobind®蛋白A(93PRAP06HB-12-A)吸附剂。在初步澄清之后(参见图5的分析),样品通过蛋白A单元过滤。IgG与蛋白A吸附剂结合,而污染物则通过了吸附剂。蛋白A的洗脱可以通过HPLC-SEC分析进行检查(参见图6)。
通过蛋白A亲和层析试验分析的洗脱样品表明了单克隆抗体的显著纯化效果。聚合物和污染物的百分比显著降低。采用HPLC-SEC分析的流出组分显示了两个峰值(图6)。基于各自的截留时间,这些峰值可以使用标准值以分子大小进行计算。获得的峰值面积提供了关于mAb溶液中聚合物和单体的百分比信息(表4)。
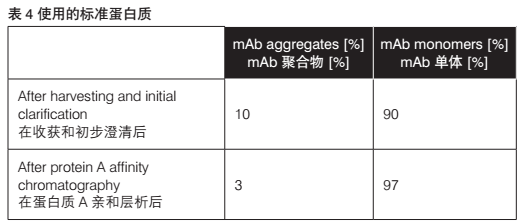
收获和初步澄清(图5)后,对mAb聚合物和单体的百分比实行的SEC分析表明污染mAb的10%聚合物仍然存在(表4)。SEC分析实验表明(在使用蛋白质A亲和层析的额外纯化步骤后),聚合物的百分比下降至3%(图6)。SCE分析未再检测到更多污染物。所获结果清楚表明使用的这种方法是合适的。
总结
HPLC-SEC分析是确定治疗性蛋白质纯度的重要工具,并且在全世界范围内用作测量聚合物含量和污染物百分比(单克隆抗体制造过程)的标准方法。
鉴于蛋白质的完整性——在这种情况下,单克隆抗体由于温度变化、机械应力影响、pH波动和生产过程中以及整个生命周期中的紫外线照射的影响而受到威胁,因此,建立确定单克隆抗体纯度的可靠方法是至关重要的。
本文所述的方法能够很好地确定单克隆抗体的聚集状态。此外,它表现出了优秀的净化效果。实施这种方法的基本先决条件是所使用物质和溶液的纯度,特别是用于制作溶液的基本溶剂所采用的水。如初步试验(图3)所示,由arium® pro VF生产的超纯水适合作为溶解缓冲物质和盐的介质,进而制备SEC使用的流动相。
使用 arium® 超纯水时,没有检测到流动相和固定相相互作用而产生的假峰,也没有检测到紫外线活性污染物或峰位移。以高TOC值形式表示的强有机杂质可能表现在峰位移中,因为随着试验进行,色谱柱基质变得更加非极性。重金属盐或螯合剂可以屏蔽色谱柱中的电荷,而这可能导致蛋白质折叠(增加抗体聚合物的形成)。这些假设必须在进一步的实验中予以澄清。