辉瑞(Pfizer)与礼来(Eli Lilly)近日宣布,美国食品和药物管理局(FDA)已受理单抗药物tanezumab(2.5mg,皮下注射[SC])的生物制品许可申请(BLA),该药目前正被评估用于治疗:接受其他止痛药后疼痛缓解不足、由中度至重度骨关节炎(OA)引起的的慢性疼痛患者。FDA已指定处方药用户收费法(PDUFA)目标日期为2020年12月,在受理通知书中,FDA表示目前正在计划召开一次咨询委员会会议,讨论这份BLA。
tanezumab是一种非阿片类止痛药,归类为神经生长因子(NGF)抑制剂。在美国,有超过2700万人患有OA,其中1100万人患有中重度OA。目前,可供选择的中重度OA治疗方案并不能满足所有患者的需求,许多患者通过多种治疗手段寻找缓解疼痛的方法。如果获批,tanezumab有潜力成为治疗OA疼痛的首个NGF抑制剂类止痛药。
tanezumab是一种人源化IgG2单克隆抗体,通过选择性靶向结合并抑制神经生长因子(NGF)发挥作用。在机体受伤、炎症或慢性疼痛状态下时,体内NGF水平会升高。通过选择性抑制NGF,tanezumab可能有助于阻止肌肉、皮肤或器官产生的疼痛信号到达脊髓和大脑。tanezumab具有与阿片类药物和其他镇痛药(包括非甾体类抗炎药[NSAIDs])不同的崭新作用机制。在迄今为止的研究中,tanezumab还没有表现出成瘾、误用或依赖的风险。
tanezumab由辉瑞研制,礼来在2013年与辉瑞签订了一份高达18亿美元的协议,推进该药的全球共同开发和商业化。2017年6月,美国FDA授予tanezumab治疗骨关节炎(OA)疼痛和慢性下腰痛(CLBP)的快速通道资格。tanezumab是第一个获得快速通道资格的NGF抑制剂。该药有潜力成为治疗OA疼痛和CLBP的首创(first-in-class)药物。
tanezumab:或成首个NGF抑制剂类止痛药
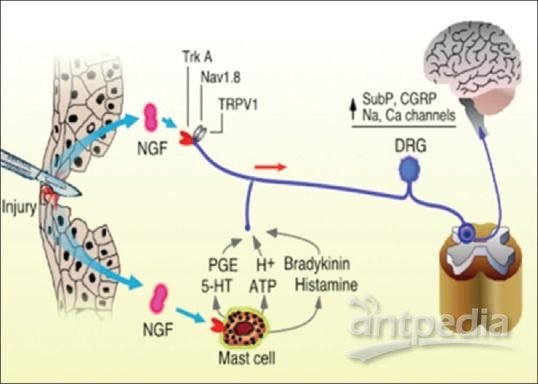
神经生长因子(NGF)调节疼痛信号进入中枢神经系统
tanezumab的监管申请文件中包含了39项1-3期临床研究的数据,这些研究在超过18000例患者中评估了tanezumab的疗效和安全性,其中有3项III期研究评估了tanezumab皮下注射(SC)治疗中度至重度OA患者。
辉瑞全球产品开发部tanezumab开发团队负责人Ken Verburg表示:“FDA受理tanezumab的申请是一个重要的里程碑,我们提交的监管申请文件的广度反映了我们在开发过程中为tanezumab收集的大量临床数据。骨关节炎(OA)治疗迫切需要创新,因为十多年来还没有新的药物可用于治疗这种致衰性疾病。如果获得批准,对于因中重度骨关节炎(OS)而遭受慢性疼痛、并且接受其他止痛药疼痛缓解不足的患者,tanezumab将成为一种首创(first-in-class)疗法。”
礼来生物制药总裁Patrik Jonsson表示:“骨关节炎(OA)患者面临着巨大的负担——由于所经历的身体疼痛,生活的方方面面都会受到影响。这种疼痛会影响患者参与日常活动的能力,从而产生重大的心理、社会和社交后果。我们期待着与FDA密切合作,为患有中重度骨关节炎的患者带来tanezumab这种创新疗法。”