肿瘤免疫治疗的CAR-T疗法,CAR- T,全称Chimeric Antigen Receptor T-Cell Immunotherapy,即嵌合抗原受体T细胞免疫疗法;原理在于经嵌合抗原受体修饰的T细胞,可以特异性地识别肿瘤相关抗原,使效应T细胞的靶向 性、杀伤活性和持久性均较常规应用的免疫细胞高,并可克服肿瘤局部免疫抑制微环境并打破宿主免疫耐受状态。
2014 年12月6号-9号在旧金山举行的美国血液学会年会(ASH)上,癌症免疫疗法可谓是赚足了眼球,CAR-T疗法更是在会议中大放异彩。会中多项报告发布 了CAR-T疗法最新的喜人进展,这些突破的成果让从事CAR-T疗法的公司大大受益,也为该领域带来了更多的投资。
2017年10月19日,美国政府批准第二种基于改造患者自身免疫细胞的疗法(yescarta疗法)治疗特定淋巴癌患者。yescarta疗法属于嵌合抗原受体T细胞(car-T)疗法。
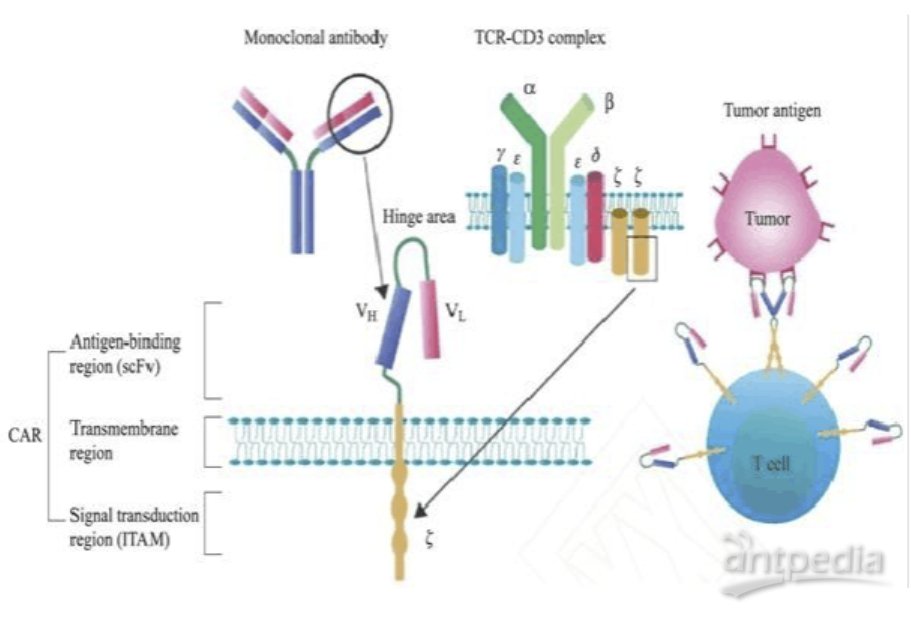
CAR-T细胞治疗技术具有鲜明的靶向性, 在病人体内可长期存在,并且不依赖于抗原递呈,因此具有彻底清除肿瘤细胞的潜力,这已经在CD19+的急淋性白血病治疗上得到了证实。
通俗的讲,CAR-T细胞免疫治疗给癌症的治疗提供了新途径。
血压瘤中的CAR-T细胞静脉注射后,CAR-T在循环系统中就可以和癌细胞发生接触,从而起效。而在实体瘤CAR-T的另一个问题就是肿瘤组织过于致密,T细胞很难进入肿瘤组织中。现在临床上CAR-T效果比较好的实体瘤种类除了急淋性白血病外,为肺癌、黑色素瘤、肾癌、卵巢癌、前列腺癌(均为T细胞浸润较多的肿瘤类型),以及脑胶质瘤(可以颅腔直接注射CAR-T)。
但是攻克癌症的道理任重而道远,并不是所有的实体瘤都已经被CAR-T识别并攻克,另外注射后会有头痛、发热的情况发生,称为细胞因子风暴。未来需要进一步的研究并临床论证。
治疗流程
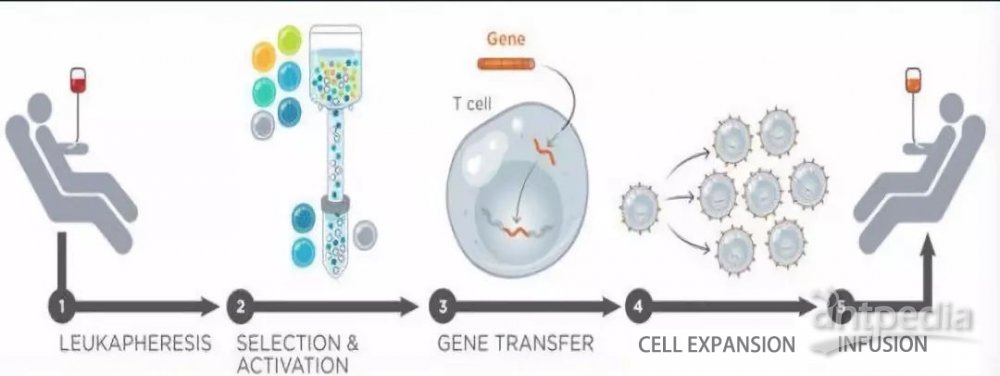
一个典型的CAR-T治疗流程,主要分为以下五个步骤。
①分离:从癌症病人身上分离免疫T细胞。
②修饰:用基因工程技术给T细胞加入一个能识别肿瘤细胞并且同时激活T细胞的嵌合抗体,也即制备CAR-T细胞。
③扩增:体外培养,大量扩增CAR-T细胞。一般一个病人需要几十亿,乃至上百亿个CAR-T细胞(体型越大,需要细胞越多)。
④回输:把扩增好的CAR-T细胞回输到病人体内。
⑤监控:严密监护病人,尤其是控制前几天身体的剧烈反应。
整个疗程持续3个星期左右,其中细胞“提取-修饰-扩增”需要约2个星期,花费时间较长。
CAR-T,全称是Chimeric Antigen Receptor T-Cell Immunotherapy,嵌合抗原受体T细胞免疫疗法。这是一个出现了很多年,但是近几年才被改良使用到临床上的新型细胞疗法。和其它免疫疗法类似,它的基本原理就是利用病人自身的免疫细胞来清除癌细胞,但是不同的是,这是一种细胞疗法,而不是一种药。
CAR-T,是Chimeric Antigen Receptor T-Cell Therapy(嵌合抗原受体T细胞疗法)的简称,是一种比较新式的肿瘤免疫疗法。它把病人自身免疫系统的T细胞提取出来,经过体外培养和改造,给这些T细胞装备上特殊分子,使它们能识别并攻击特定的癌细胞,再把改造过后的T细胞注射回病人身体,由这些T细胞针对癌细胞的免疫反应来消灭癌细胞。
CAR-T疗法的关键之一,就是要给T细胞装备能识别特定癌细胞的分子,就像装备特殊的探测器。被改造以后的T细胞就成为CAR-T细胞,它们在身体内四处游走,一旦探测器接收到来自别的细胞表面的特异信号,就会激活CAR-T细胞,发动攻击,把带信号的细胞当作敌人消灭掉。
在最近的一篇JEM论文里,我们可以看到用活体荧光成像在小鼠模型里拍摄到的CAR-T细胞暴揍/杀灭癌细胞的工作过程
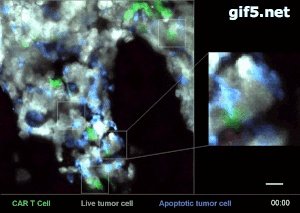
其中,白色荧光的是急性B淋巴细胞白血病(B-ALL)的癌细胞,绿色荧光的就是经过改造的CAR-T细胞,能特异地探测到B-ALL癌细胞并发动攻击,而发出的蓝色荧光呢,就是癌细胞被攻击后开始凋亡的标志。
从图的放大部分,可以清楚地看到一个绿色的CAR-T细胞在白色的癌细胞上逗留/撕扯了一会,白色的癌细胞就迅速地显出了蓝色的死气来,而肿瘤杀手小尖兵CAR-T细胞,也不流连战场,迅速离开这个被歼灭的癌细胞,奔着下一个带信号的癌细胞去了。
这些被改造的肿瘤杀手小尖兵CAR-T细胞,其实无法分析对手究竟是不是癌细胞,只能分得清有没有信号:有信号就干掉它,没信号就放开它。
设想一下,如果正常细胞也携带着这个信号分子,T细胞就会不分青红皂白地发动攻击,直至全军覆没、不死不休,从而带来很大的毒副作用。
因此,这个信号分子的特异性就非常重要。
但由于癌细胞都是从正常细胞癌变产生的,实际上是很难找到仅仅存在于癌细胞表面、却不存在于正常细胞表面的信号分子的。
目前,CAR-T疗法在临床上取得的成功,大都是在由B细胞发展成的肿瘤中,比如B细胞非霍奇金淋巴瘤(B-cell non-Hodgkin lymphoma,NHL)、弥漫性大B细胞淋巴瘤(Diffuse large B-cell lymphoma,DLBL)以及急性B淋巴细胞白血病(B-ALL)。这是因为被现有技术改造的T细胞,能特异识别B细胞表面抗原,从而把病人体内所有的B细胞——不管是癌还是正常细胞——一股脑儿全都消灭掉。毕竟,一个人即使没有了正常的B细胞还是可以活下去的,这么做问题不大。
但是,假如没有了正常的神经细胞、血管细胞、皮肤细胞,人就比较痛苦了。所以CAR-T疗法还未能针对其他细胞——这也是CAR-T目前在实体瘤里尚未取得突破的原因之一。
NEJM在2018年7月发表过CAR-T界两位大佬Carl June和Michel Sadelain的综述文章,介绍了CAR-T的发展、应用、毒性、挑战和前景[3],大家可以点击文末“阅读原文”,查阅NEJM医学前沿翻译的中文版。

CAR-T疗法的诞生,很大程度上要归功于Michel Sadelain医生等人从上世纪九十年代早期就开始潜心研究怎样改造T细胞、让它们攻击癌细胞。
而CAR-T疗法后来能成功走向临床应用、并走入大众视野,则与费城儿童医院的Carl June医生用CAR-T试验疗法成功治疗了Emily Whitehead小姑娘的故事分不开的。
一名叫Emily Whitehead的小姑娘在五岁时不幸患上急性B淋巴细胞白血病(B-ALL)。B-ALL是一种在儿童中最常见的白血病,治愈率高达85-90%,但是那另外10-15%的难治、易复发患者的病情就比较棘手,存活率很低。


而Emily小姑娘患上的B-ALL,就是难治的这一种,在经过化疗、骨髓移植以后仍然复发,到了无药可救的阶段。当时费城医院刚启动CAR-T疗法的临床试验,Emily幸运地成为了第一个接受这种疗法的儿童。
Emily的T细胞被改造之后,回到她的体内,非常积极地清除癌细胞,在它们努力消灭白血病过程中释放出的大量细胞因子,一度到了令Emily的身体无法承受的程度。这是医疗团队事先完全无法预料的危险状况,险些令人措手不及。
而巧合的是,Carl June医生的女儿因为患有类风湿关节炎,正在接受抑制同一种细胞因子的治疗,这让Carl June能够迅速地做出判断,争分夺秒地找到有效药,控制住了Emily的细胞因子风暴,救了Emily的命,也救了CAR-T——Emily从细胞因子风暴中活了下来,CAR-T疗法旗开得胜,治好了她的白血病。
今年,Emily 14岁了。她无癌生活七年,有一个以自己名字命名的基金会,专门为肿瘤研究治疗募款(http://emilywhiteheadfoundation.org/)。
随着Emily的例子被媒体广泛报道,CAR-T疗法也走到聚光灯下。几家公司为了抢头筹,战得如火如荼,吃瓜群众看得好不热闹!后来还是诺华的药物Kymriah抢先一步,于2017年8月成为首个获得FDA批准上市的CAR-T疗法。而Kite公司的药物Yescarta则紧随其后,于同年10月获批。
想想CAR-T疗法的复杂程度,就知道它一定很贵,据说诺华的Kymriah好像是要40w+美刀?要是不考虑价格的话,对那些无药可救的患者来说, CAR-T确实赋予了他们生存的机会。Nature Medicine杂志去年10月在一篇论文中附带总结了多个CAR-T临床试验的结果,在369个接受CAR-T治疗的病例中,仅有79例复发[4],对于已经别无选择、绝境中的患者来说,这样的成功率,还是很高的,很不容易。
01
在那些经过CAR-T治疗后复发的病例中,很多都是因为癌细胞学会了自我调整,不再表达能被T细胞识别的特殊信号,从而逃脱了被消灭的命运,才导致了白血病的卷土重来——就好比是,放弃白袍子、火焰纹章和横幅等一切可识别信号的明教徒,变得和普通路人一样,也就躲过了少林团队以及六大门派的围攻。
02
上面提到的这篇论文[4],讲述的是由来自CAR-T重镇费城的团队发现的、另一种与CAR-T制造技术有关的白血病耐药、复发的机制:一位B-ALL患者的T细胞通过抽血被提取出去、在体外培养和改造的同时,有一个白血病胚细胞也混在T细胞当中,接受了改造,最终导致其白血病复发。
“白血病胚细胞被改造”的结果,就是它表面的特殊信号被掩盖了,不再被T细胞识别,从而逃脱了攻击,再不断自我复制,从星星之火变成燎原——这就相当于是明教的人剃光头发、混进了少林当卧底、在光明顶覆灭之后再卷土重来吧。
费城的研究团队又仔细分析了其它患者样本,发现这个情况是无独有偶的,因此这算是一种新的抗药复发机制。这说明,现在已经很严格了的CAR-T制造技术,还是需要不断改进,才能在体外培养改造的T细胞中更严格地避免癌细胞的污染、以及随后可能会产生的抗药性。
03
而 “移祸江东”,就是现在发现的第三种癌细胞对CAR-T疗法抗药、复发的方式了。
研究人员发现,有一些经过CAR-T治疗后复发的患者,他们的癌细胞还保留着能被T细胞识别的特殊信号——虽然表达水平有所降低,毕竟这些信号还在,为什么T细胞不能识别信号、杀灭癌细胞呢?
通过在小鼠模型里的研究,他们发现,癌细胞是通过一种叫做“胞啃作用”(trogocytosis)的方法,把自己身上的特殊信号给转移到T细胞身上去了[1]——这样一来,不但降低了癌细胞自己的特殊信号、减少了被攻击的可能,还能引起T细胞之间的自相残杀和疲敝——T细胞减少攻击性,癌细胞也就躲过了一劫。
剑桥大学有位卷卷头发的Gerard Evan先生,最近在Nature上发表了一篇书评文章,评论Michael S. Kinch 的新书 The End of the Beginning: Cancer, Immunity, and the Future of a Cure 的时候,对科普写作中常见的把癌细胞拟人化的写法,提出了一定的批评,认为这种写法会误导读者对肿瘤细胞科学的理解。(https://www.nature.com/articles/d41586-019-01100-1)
他是这么说的:“癌症没有大脑、没有计划、没有自由意志;它们既没有美德也不存在恶意。对于癌细胞来说,不存在‘粗心’或者‘大胆’的做法,没有所谓的细胞决定不执行常规功能的‘选择’,也不存在主动利用T细胞当作盾牌的做法。癌细胞没有邪恶的主观意志,它们只是由于软件故障而自动运行的机器人。”
Cancers have no brain, no plan, no free will; they bear neither virtue nor malice. Cancer cells do not exhibit "carelessness" and are not "audacious"; there are not "choices by a cell not to perform its regular housekeeping chores" or to use T cells as "human shields". Cancer cells are automatons that act because of corrupted software, not evil purpose. We must never forget that people with cancer are patients — not contestants locked in some epic struggle with their disease.
我觉得他说的是很有道理的。虽然我自己在跟别人解释一些现象的时候,也免不了会用到拟人的说法和比喻。
但是,癌细胞并没有心机、不会思考,它们也并没有主动地刻意设计出各种逃脱CAR-T疗法(或者其它疗法)的生存策略。
癌细胞的耐药和复发,与英国斑点蛾、耐药细菌一样,都是自然选择的结果:不同的癌细胞在不同的时间、地点做着不一样的动作,那些被抗癌疗法杀死了的,便是被杀死了,变成过眼云烟。但是在数不胜数的癌细胞中,倘若刚好其中有细胞能够偶然地逃脱疗法、偶然地存活下来、偶然地卷土重来……这些经过抗癌疗法的筛选后还活着、复发的癌细胞后代,就会造成新的、可能更大的麻烦,自然也就被发现了。