2020年中国CAR-T细胞治疗发展现状及竞争格局
两款靶向CD19的CAR-T产品进 入申请阶段
细胞免疫治疗,亦称为过继细胞(ACT)治疗,是一种将免疫细胞(主要为T细胞)注入患者以治疗癌症的免疫疗法。T细胞通常取自患者自身的血液或肿瘤组织,并在实验室大量培育,然后再输入患者体内以帮助免疫系统杀死肿瘤细胞。细胞免疫疗法的主要类别包括CAR-T,TCR-T,NK及TIL。

CAR-T是经基因改造以产生人工抗原受体的T细胞,从而使T细胞拥有靶向特定蛋白质的新能力。经基因改造后的T细胞表面存在称为嵌合抗原受体(CAR)的受体。CAR可与肿瘤细胞表面上的抗原结合,以触发细胞内信号传导,从而激活T细胞以消除肿瘤细胞。CAR-T疗法具有下列特定优势:

2017年被称为CAR-T元年,也是CAR-T技术正式商业化之年。2017年8月,诺华用于治疗B细胞急性淋巴白血病的全球首款CAR-T疗法Kymriah获FDA批准上市,成为全世界首个获得批准上市的CAR-T产品。同年10月,Kite的KTE-C19同样获得美国FDA批准上市,此两款药物成为全球唯二的两款CAR-T上市产品。
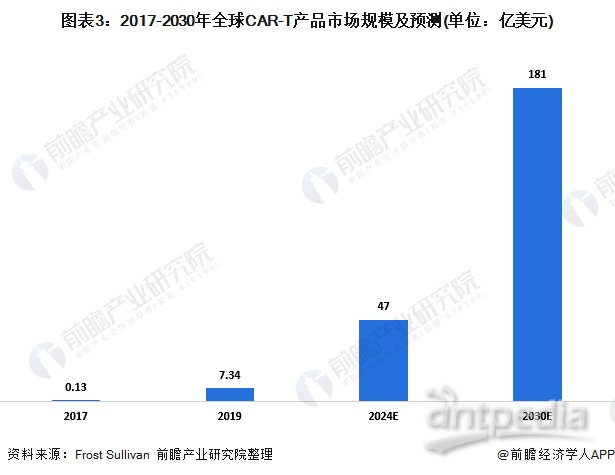
2017年,在首两款CAR-T产品Yescarta及Kymriah获批准后,全球CAR-T市场由2017年的约1300万美元增至2019年的约73400万美元,预期于2024年将进一步增长至47亿美元,并于2030年增长至181亿美元。
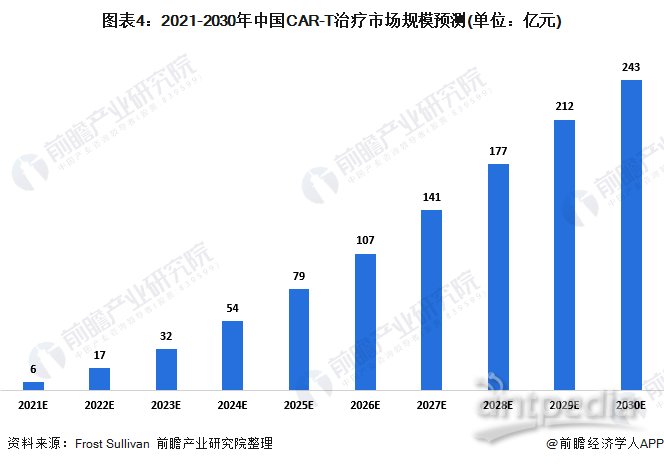
虽然中国目前尚未有获批准的CAR-T产品,但由于预计即将推出新产品,中国的CAR-T市场预期将于2021年增长至人民币6亿元。由于确诊癌症患者上升、负担能力提升以及利好监管环境,中国CAR-T市场预期将于2024年增长至人民币54亿元,并于2030年增长至人民币243亿元。
CD19是参与B细胞活化和增殖的重要膜抗原之一。B细胞在除浆细胞阶段的其他所有阶段均会表达CD19。CD19参与调节B细胞受体依赖型(BCR依赖型)与BCR非依赖型信号,对身体产生最佳免疫应答至关重要。大部分B细胞恶性肿瘤(如NHL、ALL及CLL)的患者癌细胞中均表达正常或高水平数量的CD19。
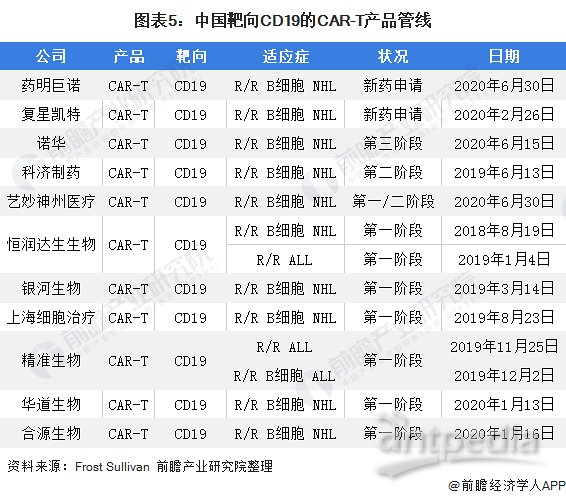
靶向CD19的CAR-T通过阻止BCR或其他相关配体与CD19结合而发挥作用,同时CAR-T细胞可引发T细胞的免疫活性。CD19+细胞与CAR-T细胞的结合会激活T细胞受体的信号传导级联反应,从而导致体液免疫反应整体受损,并最终使目标肿瘤细胞裂解。下表列示中国靶向CD19的CAR-T产品管线。
中国CAR-T进入黄金时代
2018-05-02,近年来,中国医药创新能力和产出快速提高,医药企业新药研发领域的投资热度也空前高涨,研发费用投入逐渐加大。同时,在国家一系列促进创新药发展的支持政策下,中国的生物技术产业正在悄然强势崛起。CAR-T就是中国创新药快速发展的典型,有望助力我国生物医药实现弯道超车。
CAR-T迎来三百亿美元市场空间,中国CAR-T快速崛起
CAR-T中文名是“嵌合抗原受体T细胞”,是肿瘤免疫治疗的新兴手段之一,是一种经过基因修饰并获得特异的靶向性效应T细胞,在复发性、难治性白血病、淋巴瘤、多发性骨髓瘤等血液肿瘤相关领域的治疗中均展现了高水平的治疗效果。
2017年被称为CAR-T元年,也是CAR-T技术正式商业化之年。2017年8月,诺华用于治疗B细胞急性淋巴白血病的全球首款CAR-T疗法Kymriah获FDA批准上市,成为全世界首个获得批准上市的CAR-T产品。同年10月,Kite的KTE-C19同样获得美国FDA批准上市,此两款药物成为全球唯二的两款CAR-T上市产品。
以诺华和Kite为代表的国外机构相继推出CAR-T产品的同时,中国的企业也在奋起直追,CAR-T研发和产业化势头强劲,有望实现弯道超车,与国际巨头在CAR-T领域同场竞技。
数据显示,截至2018年4月,在Clinicrials上注册过的中国CAR-T细胞产品的研究项目共158个,超过欧洲两倍,仅次于美国试验项目166个,便显出与美国并驾齐驱的态势。
2009年卫生部发布一系列支撑政策,免疫细胞疗法被列入第三类医疗技术加以规范,于2011年、2012年被纳入国家重点支持和发展产业。2017年11月,在《治疗用生物制品注册受理审查指南(试行)》的指导下,中国CAR-T治疗药品临床试验申报开始受理,国内CAR-T将迎来新药研究申请获批潮。
根据国家食药监总局CDE官网信息,银河生物、恒润达生、科济生物、博生吉安科、明聚生物、优卡迪生物、艺妙医疗等多家企业的靶向CD19新药研究申请相继获得CDE优先审评。其中,银河生物、恒润达生、科济生物于3月12日获批临床,成为我国CAR-T第一梯队企业。
机构预测,随着我国《细胞治疗产品研究与评价技术指导原则》于12月22日正式发布,预计CAR-T将迎来新药研究申请获批潮,标志着我国CAR-T进入黄金发展时代。
西南证券研究团队认为,CAR-T产业将迎来黄金十年,预计到2027年全球血液瘤CAR-T销售额可达278亿美元,其中我国的CAR-T血液瘤市场规模将达到100亿人民币。同时,考虑到CAR-T是肿瘤免疫疗法未来的发展趋势,如果在维持缓解率的基础上,进一步提高安全性水平CAR-T将有望攫取更大的血液瘤市场份额,或将超过千亿美元。
银河生物领衔中国CAR-T进入黄金时代
2018年1月29日,上市公司银河生物(000806.SZ)发布新药研发项目进展的公告,全资子公司成都银河、控股公司北京马力喏生物科技有限公司及四川大学联合提交的CAR-T药物“抗CD19分子嵌合抗原受体修饰的自体T淋巴细胞注射液”临床试验申请已处于国家食品药品监督管理总局审评审批中,并纳入优先审评范围。而根据CDE官网信息,银河生物的CAR-T药物临床试验已经获得正式批准。公司在年报中表示,“预计近期内可获得临床试验批件”。
银河生物是国内较早进入CAR-T细胞免疫疗法研发的公司,2015年11月,银河生物与四川大学生物治疗国家重点实验室签署达成合作,共同开发抗肿瘤CAR-T细胞新药。四川大学生物治疗国家重点实验室魏于全院士团队已从事CAR-T研究逾10年,其中靶向人CD19的CAR-T细胞治疗血液肿瘤技术已经进入临床试验研究阶段。
2016年12月,银河生物子公司成都银河以1.2亿现金分步增资北京马力喏生物科技有限公司,获得50%股份。北京马力喏的CAR-T研发技术国内领先,其研发的改良型抗CD19CAR-T细胞治疗产品的临床试验效果显著:治疗有效率达70%,在高剂量组有效率达到约80%,其中完全缓解率(CR)达55%,疗效持久并且副作用小,只有3例患者出现低热反应,所有25例治疗病人无严重不良反应,均未出现严重细胞因子风暴及神经毒性不良反应。
研究机构认为,银河生物通过参股北京马力喏,并与四川大学的重点实验室团队合作,充分发挥银河生物的上市公司平台优势,有利于加快CAR-T技术的研发进程,并顺利推进CAR-T技术的产业化。
只有真正掌握核心技术,才能在众多CAR-T公司中脱颖而出。银河生物联合四川大学生物治疗国家重点实验室,参股北京马力喏,打造拥有自主知识产权的CAR-T核心技术,在国家政策的大力支持下,有望率先完成商业化,成为我国CAR-T领域的首批上市企业。