过去十年,CAR-T治疗进展迅速,有阻碍,也有进步。
CAR-T治疗效果要得到保障,流式细胞术少不了。流式在CAR T细胞疗法中有多种关键性的应用:
在CAR T制造的前期阶段,流式细胞术可用于分析单采血液分离产品的成分,并确定与预后更好或更差相关的供体T细胞的特定群体。例如,CD27 + CD45RO-CD8 + T细胞的比例增高,与抗CD19 CAR T细胞治疗CLL患者的持续缓解有关,如果这类细胞少或缺失,则与治疗失败有关(Fraietta et al,2018)。类似地,BCMA特异性CAR T细胞如果CD8 + CD45RO ? CD27 +亚群比例高,则在多发性骨髓瘤患者中治疗效果越好(Cohen et al,2019)。
在另一项研究中,B-ALL儿童患者血液中分离出的初代T细胞中,如果LAG-3 + / TNF-alpha-low CD8 +亚群多,则这类患者就容易发生抗CD19 CAR T治疗失败(Finney et al,2019)。
这些研究表明,尽管需要分析的T细胞表型可能在不同疾病和不同治疗方法之间有所不同,但是对单采细胞中T淋巴细胞的表型分析,可以为CART细胞的生产以及进一步的患者管理提供预后评估的指标。
流式细胞术还可用于评估输注之前CAR T细胞的表型和功能。抗CD19治疗CLL后表现出完全应答的患者,其CAR T细胞可产生更高水平的STAT3相关细胞因子(包括IL-6、IL-17、IL-22、IL-31、CCL20),并且血清IL-6水平与CAR T细胞扩增相关。表达高水平的IL-6受体的CD27 + PD-1 ? CD8 + CAR T细胞可预测治疗反应的改善(Fraietta et al,2018)。在CAR-T治疗有效的小鼠白血病模型,如果去除CAR T产物中CD27 + PD-1-CD8 + T细胞群,则会导致白血病复发(Fraietta et al,2018)。相反,某些标志物的存在预示着治疗失败,例如:CD8 + PD-1 +表型的CAR T细胞百分率高则预示治疗失败,PD-1和LAG-3的共表达或TIM-3表达与预后差相关(Finney et al,2019; Fraiettaet al,2018)。采用流式细胞术算法来确定可预测患者对免疫疗法反应的CAR T细胞生物标志物,从而可以帮助建立预后模型,并最终导致更个性化的治疗方法(Aghaeepour et al,2012;Bruggner,Bodenmiller,Dill,Tibshirani, Nolan,2014;Pouyan & Nourani,2017)。
输注后,流式细胞术成为监测CAR-T细胞扩增和持久性、评估治疗反应的必要工具。例如,在抗CD19 CAR T细胞用于治疗儿童和成人复发性和难治性 B-ALL的临床试验中,流式细胞仪用于量化CAR T细胞扩增的程度,并检测是否存在对治疗有反应的患者的骨髓和脑脊液中的CAR T细胞(Grupp et al,2013; Maude et al,2014)。治疗后,需用流式细胞术对这些患者进行了纵向随访,明确获得持续缓解的患者中MRD阴性,并及时发现复发的患者。在复发的情况下,流式细胞术还有助于确定白血病细胞的数量和表型,例如在一名儿童B-ALL复发的情况下,流式可发现患儿的原始细胞出现CD19抗原的丢失(Grupp et al,2013年)。
在输注之前和之后,对CAR产品进行评估时,需要考虑的一个重要因素是要确保方案能够鉴定出CAR阳性的白血病细胞。尽管非常罕见,但有报道称在CAR T细胞生产过程中CAR也能转染到白血病细胞上,从而与治疗性CAR T细胞混在一起,最终导致复发。这种耐药机制是在接受抗CD19 CAR T细胞后复发的B-ALL患者中发现的(Ruella et al,2018)。这凸显了需要使用流式细胞术而不是仅仅依靠qPCR监测CAR T扩增的重要性,因为流式能够使我们确定正在扩增的CAR阳性细胞是否存在非T细胞群体(白血病细胞)。
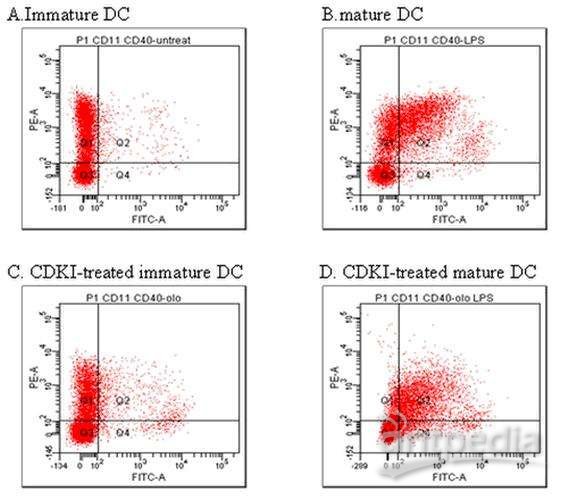
CAR表达的检测蛮有挑战。传统上,使用针对CAR的细胞外部分的荧光抗体,流式细胞术能够检测CAR。山羊抗小鼠抗体已被用于鉴定用鼠scFv构建的CAR,但该方法不适用于使用人源化或完全人源抗体构建的抗原识别域的CAR,或基于非抗体的CAR。此外,许多多克隆抗体之间的变异可能导致结果不一致(Ascoli&Aggeler,2018; Voskuil,2014)。
针对其同源CAR受体抗原结合结构域的抗独特型单克隆抗体可以高度特异性地检测CAR(Jena et al,2013)。但是,对于临床流式细胞实验室来说,一个重要的问题是,尽管存在抗独特型抗体可用于检测许多CAR T产品,但这类抗体并没有商品化,这导致缺乏用于鉴定抗原特异性CAR的“金标准”,并使CAR检测的标准化变得困难。有多种可用于检测CAR表达的试剂和策略,但是这些试剂不是通用的,需要对每种CAR T产品类型进行验证。Jozwik等人在2020年发表了一个流式细胞术方案,可检测“通用”同种异体CAR T细胞,其中CAR来源于抗人CD19鼠单克隆抗体的scFv,并且剔除了TRAC和CD52基因。
基于抗体的流式细胞术固有的一个问题是抗体与白细胞和死细胞的非特异性结合,产生背景荧光。添加死细胞排除染料(例如7AAD)有助于识别死细胞,从而避免死细胞导致的非特异性结合影响结果。由于CAR T细胞通常很大且被活化,因此它们的前向散射光与侧向散射光(FSC / SSC)在某种程度上可以与单核细胞重叠,所以有必要包含单核细胞标记物(例如CD14)排除单核细胞干扰。IgG1和IgG2a与单核细胞上表达的Fc受体的非特异性结合可以通过使用商品化Fc阻断剂、小鼠或人血清或高浓度的小鼠或人IgG阻断。但是,对于基于modular Fc的CAR T细胞,Fc受体阻断可能掩盖CAR分子的抗原识别域,因此必须使用对CAR结果中的非抗原结合部分具有特异性的检测分子来实现其鉴定。
基于蛋白质L的检测方法可检测基于抗体的CAR,而不会涉及其抗原结合位点(Zheng,Chinnasamy,&Morgan,2012)。蛋白质L是一种细菌的表面蛋白质,从大肠拟肽链球菌中分离出来。它选择性地结合免疫球蛋白和Fab片段的κ轻链,但不结合它们的Fc部分。它具有识别单链抗体片段的能力,使其成为检测细胞表面CAR表达的便捷试剂。用生物素标记的蛋白L标记淋巴细胞,然后用PE偶联的链霉亲和素进行染色,可以高度特异性地检测源自鼠和人scFv的CAR,其结果与使用山羊抗小鼠抗体或抗原 Fc /山羊抗人IgG一致(Zheng等,2012)。该方法的缺点是它也会标记κ阳性的B细胞,因此需要多标记一个CD3,以将CD3 + CAR + T细胞与已被CAR构建体转导的B细胞区分开。
检测CAR还有一个很好的方法是利用荧光染料标记的对应抗原。基于可溶性抗原的检测方法不仅可以评估CAR在细胞表面的表达,还可以证实CAR能够与其同源抗原结合。例如,使用CD19sIg(一种由人CD19细胞外域和与 Alexa Fluor 488 人IgG1的Fc段组成的融合蛋白)通过流式细胞术可检测低至0.5%的CAR T细胞,且背景染色最少。(De Oliveira et al,2013)。使用可溶性重组BCMA通过流式细胞术检测CAR T细胞表面的抗BCMA CAR表达(Bu et al,2018)。现在有多种商品化荧光标记的或预生物素化的可溶性抗原,包括CD19、CD22、CD33、BCMA和EGFR等,用于CAR T细胞检测。需要注意的是,CAR上面的配体结合表位不应被荧光染料“隐藏”或阻断,以确保CAR与抗原的顺利结合。
可溶性抗原系统的另一个例子是Topanga试剂,其中CAR抗原与一种最近发现的海洋萤光素酶融合,其亮度比常用萤火虫萤光素酶高1,000倍(Gopalakrishnan et al,2019)。已证明该测定法可与由人CD19的各种表位构建的试剂一起使用,包括完整的CD19细胞外域、非CD19抗原和不同的海洋荧光素酶。结合抗原决定簇标签后,Topanga试剂可被亲和层析纯化,并应用于流式细胞术确定表达CAR的细胞的百分比。使用Alexa Fluor 647标记的Topanga试剂通过单步流式细胞术获得的结果与使用生物素化蛋白L的多步方法所获得的结果一致性较好。此外,已证明未纯化的标签表位标记的Topanga试剂也可以用于流式细胞术检测表达CAR的细胞,无需经过耗时且昂贵的蛋白质纯化和标记步骤(Gopalakrishnan et al,2019),能够在含有多达一百万个外周血单个核细胞中检测到10个表达CAR的细胞,由于没有Fc受体、一步法和不需要二抗标记,所以非特异结合水平很低。
近年来,已开发出许多不同的评估效应细胞毒性的方法(Adan,Kiraz &Baran,2016),包括
测定死细胞释放放射性同位素或染料的方法(Brunner, Mauel, Cerottini, & Chapuis, 1968)
活细胞保留同位素或染料的方法(Neri, Mariani, Meneghetti, Cattini, & Facchini, 2001)
ATP含量检测(Nowak,Kammerer &Kupper,2018)
活细胞的酶活性(Prabst,Engelhardt,Ringgeler & Hubner,1601)
测量死细胞释放到上清液中的细胞内物质的水平(Fotakis &Timbrell,2006)
量化表达萤火虫荧光素酶的靶细胞释放发出的荧光(Brasier,Tate,&Habener,1989; Mitsuki等,2016)
每种方法都有其优点和缺点,但是只有流式细胞仪才能检测单细胞,并同时评估效应细胞及其靶标的多个参数(Martinez et al,2018; Mihara,Yoshida ,&Bhattacharyya,1904)。
高通量流式细胞仪可同时量化CAR表达、分析CAR阳性细胞的活化、脱颗粒和耗竭状态,以及区分CAR T细胞和靶细胞群(Martinez et al,2018; Mihara et al, 1904)。CAR T细胞活化的表现包括含有细胞毒蛋白的胞吐(例如穿孔素和颗粒酶)、脱颗粒功能分子的出现(例如CD107a)、存在活化标记(例如PD-1或CD25)、死亡信号分子的表达(例如Fas-L或TRAIL) ,并产生各种炎性细胞因子。有趣的是,单细胞细胞毒活性测定表明CD8 +和CD4 + CAR T细胞均具有细胞毒性(Xhangolli et al,2019),它们产生的炎性细胞因子由Th1和Th2谱系混合组成,包括IFN-γ、TNF-α、IL-5和IL-13。
流式细胞术的挑战之一是评估实体瘤中的细胞毒杀伤作用。实体肿瘤细胞需要在通过超声或酶消化进行分解才能制备单细胞悬液。酶消化(例如胰蛋白酶处理)可能会破坏表面蛋白,因此,虽然阳性结果很可能是真实的阳性结果,但由于存在假阴性可能,如果没有也不应过度解读为没有用(Donnenberg,Corselli,Normolle,Meyer &Donnenberg,2018)。不过也不用太担心,现在已开发出成功的方法来优化肿瘤细胞解离,而对细胞存活率或抗原表达的影响却最小,这样,通过高通量多参数流式细胞术,就能一次性同时检测CAR T细胞功能以及针对实体瘤细胞系的细胞毒性(Martinez et al,2018)。
靶细胞和效应细胞结合是细胞介导的杀伤所固有的现象,但是这种结合造成的粘连,会极大地阻碍传统流式细胞术进行细胞分析。解决此问题的一种方法是细胞核流式细胞术(Rabinovich et al。,2019)。
流式细胞术在细胞治疗中的另一个重要应用是评估肿瘤抗原表达和评估TME。研究表明,足够的抗原表达对于确保有效的CAR T细胞起作用是必要的。在一项试验中,发现CD19阳性B-ALL的临床缓解持久性与输注时白血病细胞上CD19的表达水平相关,并且需要足够高的抗原负荷才能触发CAR T细胞增殖( Finney et al,2019)。在另一项研究中,CD22阳性ALL中的抗原低表达与抗CD22 CAR T细胞的持久性减弱、体内和体外功能降低有关,并与CAR T细胞中初始表型增加有关(Ramakrishna et al,2019) 。增加CAR亲和力并不能改善对低抗原性白血病的反应,但给予Bryostatin1(一种上调白血病细胞上CD22表达的治疗药物)可以改善CAR T细胞的功能和体内持久性(Ramakrishna et al,2019年)。
量化肿瘤靶抗原密度在两种不同情况下可能有用。首先,可以将其用于输注前的筛选,以定义表达CAR靶抗原的异常细胞的比例和在表面表达的分子数量。该信息可能很有价值,因为很难知道什么抗原密度阈值足以触发通过CAR激活T细胞。其次,患者输注CAR-T后,以定量的方式跟踪靶抗原的表达水平可能有助于理解耐药性。
TME是实体瘤对免疫疗法产生临床反应的重要中介。流式细胞术可以区分众多肿瘤浸润免疫细胞亚群,并评估免疫抑制标志物,例如IDO1、PD-L1、FoxP3、TDO、IL-10和TGF-beta,并进行肿瘤异质区域之间的对比研究。但是,它需要开发有效的方法来分离完整的肿瘤细胞、分离浸润的免疫细胞,并以高通量的方式运行复杂的分析模板。最近有多篇文章提供了流式细胞术评估实体瘤中TME的详细方案(Young,Bolt,Ahn,&Mann,2016; Yu et al,2018)。