摘要
建立了超高效合相色谱-三重四极杆质谱(UPC2-MS/MS)测定食用植物油和油条中15种3-氯-1,2-丙二醇脂肪酸酯(3-MCPDE)含量的方法。3-MCPDE的结构与甘油酯极为相似,因此很难将其从植物油中分离出来。为降低基质干扰,实验以不同极性的溶剂依次洗脱载有样品的氨基填料层析柱,用UPC2和ACQUITY QDa质谱检测器分析每单元洗脱液以绘制洗脱曲线。分段收集的洗脱液经混合、浓缩和过滤后,以Viridis HSS C18 SB色谱柱(150 mm×2.1 mm,1.8 μm)为分析柱,超临界CO2和40%乙腈甲醇溶液(含0.1%甲酸)为流动相梯度洗脱,以97%异丙醇水溶液(含0.2%氨水)为补偿液,用配备电喷雾电离源的三重四极杆质谱在正离子、多级反应监测模式下测定,外标法定量。结果表明:15种3-MCPDE在各自范围内线性关系良好(相关系数(r2)≥0.9973),检出限为0.01~0.68 μg/L(S/N=3),定量限为0.04~1.74 μg/L(S/N=10);在3个加标水平下的平均回收率为81.6%~98.5%(n=9),相对标准偏差为1.8%~6.4%。利用该法对实际样品进行检测,并对考察范围以外的疑似3-MCPDE化合物进行了分析。该法基质兼容性强,操作简便,灵敏度高,专属性好,绿色环保,较传统方法极具优势,用于测定植物油和油条中3-MCPDE单体的种类和含量,结果满意;但该法也存在定性能力较弱、定量过度依赖单体标准品、单酯较二酯离子化效率低等问题,可作为后期研究关注的方向。
3-氯-1,2-丙二醇脂肪酸酯(3-MCPDE)的危害和污染状况近年受到国际社会的广泛关注。
3-MCPDE主要存在于食用植物油中, 且大多产生于精炼过程, 尤其是脱臭步骤, 形成机制尚不明确。
此外, 食品在烹饪、加工过程中也会生成3-MCPDE, 尤其是加入氯化物后, 3-MCPDE的含量会急剧上升。
随着研究范围的不断扩大, 研究者发现3-MCPDE广泛存在于奶粉、油炸食品、牛奶、谷物等多种食品及其原材料中。
我国于2015年开始将3-MCPDE纳入食品安全风险监测计划, 近几年相关研究及监测数据显示, 国内3-MCPDE的整体检出率居高不下, 污染状况不容乐观。
3-MCPDE的毒性目前仍不清楚, 但其代谢产物3-氯-1,2-丙二醇(3-MCPD)被证明具有生殖毒性、肾脏毒性、潜在的致癌性及免疫抑制性,是氯丙醇类化合物中危害性最大的物质, 常被作为氯丙醇的代表和毒性参照物。
3-MCPD具有两个羟基和两种光学异构体, 可与多种脂肪酸反应形成各类3-MCPD单酯和二酯, 结构上的差异使其在人体内的酶解速率、代谢途径、毒理学作用等方面表现出极大差异。
因此, 有必要对各3-MCPDE单体进行分离和测定, 为评估3-MCPDE的健康风险提供更加准确的数据。
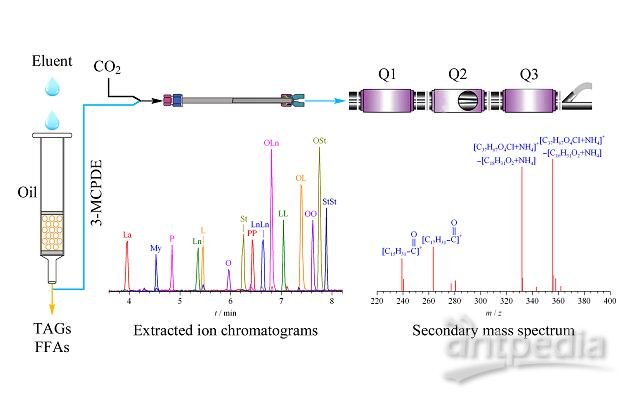
超高效合相色谱(UPC2)兼具超临界流体色谱的优势和传统高效液相色谱的易用性, 已被成功应用于甘油三酯(TAGs)、游离脂肪酸(FFAs)、塑化剂等脂溶性化合物的分析。
本实验用超高效合相色谱-三重四极杆质谱建立了测定食用植物油和油条中15种3-MCPDE单体含量的方法, 为测定植物油及油炸食品中氯丙醇酯类化合物提供了绿色环保、快速准确的新方法。
该法灵敏度高, 专属性好, 基质兼容性强, 较传统方法极具优势, 能有效测定3-MCPDE的组成和含量, 对其毒理学评价、形成机制研究等具有重要意义。
仪器与试剂
UPC2-TQS超高效合相色谱-三重四极杆质谱仪、ACQUITY QDa质谱检测器(美国Waters公司), N-EVAP-24氮吹仪(美国Organomation公司), 涡旋混合器(德国Heidolph公司); 氨基吸附剂(40 μm, 美国Agilent公司)。
标准品:1-棕榈酸-3-氯-1,2-丙二醇酯(P)、1-硬脂酸-3-氯-1,2-丙二醇酯(St)、1-油酸-3-氯-1,2-丙二醇酯(O)、1-亚油酸-3-氯-1,2-丙二醇酯(L)、1-亚麻酸-3-氯-1,2-丙二醇酯(Ln)、1,2-二棕榈酸-3-氯-1,2-丙二醇酯(PP)、1,2-二硬脂酸-3-氯-1,2-丙二醇酯(StSt)、1,2-二油酸-3-氯-1,2-丙二醇酯(OO)、1,2-二亚油酸-3-氯-1,2-丙二醇酯(LL)、1,2-二亚麻酸-3-氯-1,2-丙二醇酯(LnLn)购自日本和光公司; 1-月桂酸-3-氯-1,2-丙二醇酯(La)、1-肉豆蔻酸-3-氯-1,2-丙二醇酯(My)、1-油酸-2-亚油酸-3-氯-1,2-丙二醇酯(OL)、1-油酸-2-亚麻酸-3-氯-1,2-丙二醇酯(OLn)、1-油酸-2-硬脂酸-3-氯-1,2-丙二醇酯(OSt)购自加拿大TRC公司; 甲酸、正己烷、甲醇、乙腈、乙酸乙酯、异丙醇均为色谱纯, 购自美国Thermo Fisher公司。食用植物油和油条样品均购自当地市场。
仪器条件
色谱条件:
色谱柱为Viridis HSS C18 SB柱(150 mm×2.1 mm, 1.8 μm); 柱温为45 ℃; 流动相A为超临界CO2, B为40%乙腈甲醇溶液(含0.1%甲酸); 流速为1.0 mL/min。洗脱梯度程序为0~1.0 min, 0.2%B; 1.0~9.0 min, 0.2%B~2.0%B; 9.0~11.0 min, 2.0%B~25%B; 11.0~13.0 min, 25%B; 13.0~14.0 min, 25%B~0.2%B。系统背压为12.07 MPa; 补偿液为97%异丙醇水溶液(含0.2%氨水); 流速为0.2 mL/min; 进样体积为5 μL。
质谱参数:
电喷雾电离源, 正离子模式(ESI+); 采集方式为多反应监测(MRM)模式; 离子源温度150 ℃; 去溶剂气流量750 L/h; 去溶剂气温度350 ℃; 毛细管电压3.5 kV; 流动相切换时间设置为4~9 min切换至ESI源, 其他时间段排至废液。
03
样品溶液的制备
标准品溶液:精密称取适量各标准品, 用正己烷制成1 g/L的储备液; 再量取各储备液适量, 用正己烷稀释成1 mg/L的标准使用液, 上述溶液均置于-18 ℃冰箱保存。
样品溶液:将植物油充分混匀备用, 油条按GB 5009.6-2016《食品中脂肪的测定索氏提取法》提取出油脂后备用; 称取2.00 g氨基吸附剂, 以正己烷为溶剂湿法装入自制层析柱(经改造的10 mL酸式滴定管), 临用前排出正己烷。
称取0.100 g样品, 置于1.5 mL离心管中, 加入0.2 mL正己烷, 涡旋溶解后转入层析柱, 以0.4 mL正己烷分两次洗涤离心管, 洗涤液一并转入层析柱; 用20 mL正己烷洗脱, 控制流速为3 mL/min, 收集第7~14 mL洗脱液, 其余弃去; 再以10 mL正己烷-乙酸乙酯(6:4, v/v)洗脱, 流速同上, 收集第3~9 mL洗脱液。合并收集的洗脱液, 置于离心管中, 于60 ℃氮吹至干, 加入1 mL正己烷-异丙醇(98:2, v/v), 涡旋溶解残渣后, 过0.22 μm滤膜。