如今,世界上成百上千万人已经接种了基于mRNA技术开发的新冠疫苗。它们在帮助人们产生对新冠病毒的免疫力,控制新冠疫情的蔓延方面起到了举足轻重的作用。这种疫苗的一个关键元素是mRNA,这种遗传物质能够让我们自己身体中的细胞生成新冠病毒蛋白,从而激发免疫系统产生针对新冠病毒的免疫反应,从而预防未来可能发生的感染。
这个过程说起来简单,但是想让mRNA穿过细胞膜达到细胞内部却不是一件容易的事。基于mRNA的新冠疫苗之所以能够在新冠病毒基因组序列发布后不到一年里就获得了成功,得益于研究人员在脂质纳米颗粒(LNP)递送技术上长达几十年的努力。今天药明康德内容团队将与读者介绍这个保护mRNA,帮助它们进入人体细胞,然后又协助它们指导细胞生成病毒蛋白的“好帮手”——脂质纳米颗粒。可以说,没有它就没有现在的mRNA新冠疫苗。
mRNA疫苗中的mRNA编码着新冠病毒表面的抗原蛋白,如果能够与人体细胞内负责生产蛋白的核糖体相结合,就能够“指挥”核糖体生成病毒蛋白。不过mRNA是一种非常脆弱的分子,在我们的日常环境和身体中有很多酶能够迅速将它们降解,这是将mRNA递送到细胞内部需要解决的第一个障碍。
而且,mRNA链是一个带有负电荷的长链大分子。在人体的细胞表面有一层也带有负电荷的细胞膜,mRNA分子没法轻易穿过细胞膜进入细胞内部。这些障碍也是mRNA技术早期开发时,很多科学家认为它不可能成功的原因。
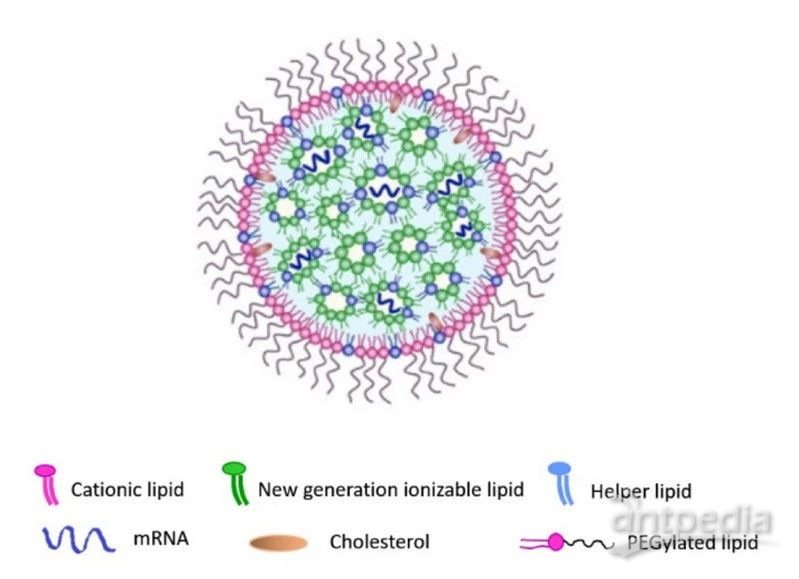
▲脂质纳米颗粒结构示意图(图片来源:参考资料[3])
如今在mRNA新冠疫苗中使用的LNP包含了这一技术在过去三十年中积累的多种创新。因为mRNA带有负电荷,所以会受到同样带有负电荷的细胞膜的排斥。所以,研究人员使用了携带正电荷的脂质分子(上图中的粉色分子)来帮助LNP进入细胞。然而,带有正电荷的脂质分子具有一定毒性,用量过多可能导致细胞膜被破坏,从而杀伤健康细胞。早期利用携带正电荷的脂质分子构建的纳米颗粒或者脂质体经常因为毒副作用而中止开发。
LNP技术的一个突破是使用了被称为“可离子化的脂质分子”(ionizable lipids,上图中的绿色分子)。它的极性随着pH值的变化会改变,在低pH值的环境中,它携带正电荷,这让它们可以与mRNA形成复合体,起到稳定mRNA的作用。然而在生理pH值时,它是中性的,这减少了它的毒副作用。
在LNP的外围,还包裹着受到聚乙二醇修饰的脂质分子(PEGylated lipid),聚乙二醇(PEG)的修饰具有多种功能,它能够防止LNP聚集在一起,控制LNP颗粒的大小,并且在最初可以起到防止LNP被人体的免疫系统发现的作用。
此外,LNP中还包含着胆固醇和其它辅助脂质分子,协助构成LNP的完整结构。
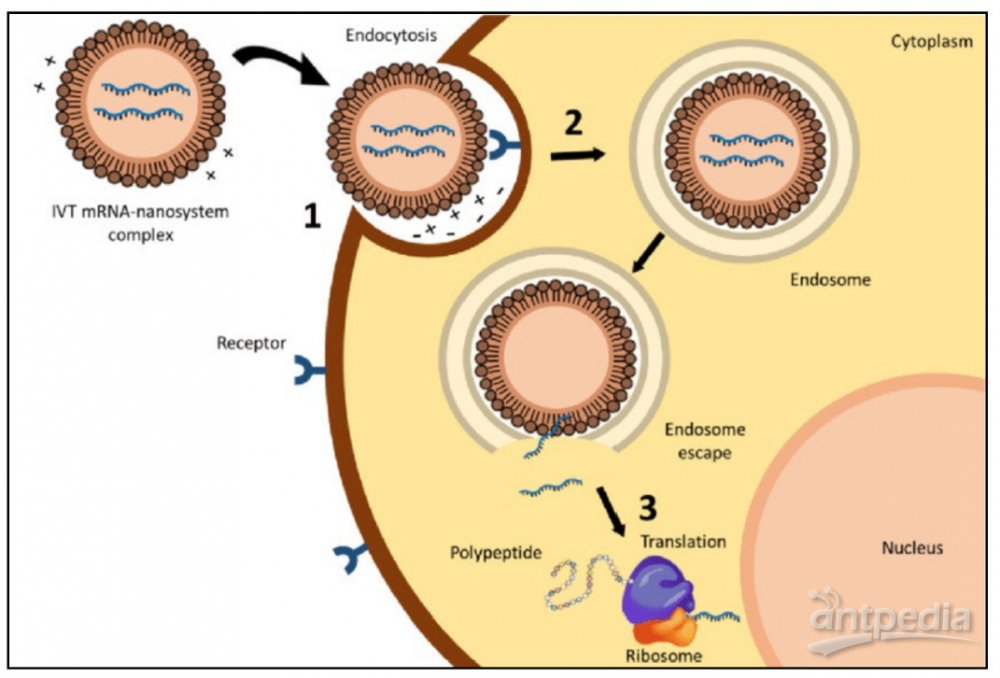
▲LNP携带的mRNA疫苗进入细胞,并且释放mRNA指导蛋白合成的示意图(图片来源:参考资料[3])
LNP在碰到细胞膜时会被细胞吞入到细胞内形成称为内体(endosome)的囊泡。在细胞内部,内体的pH值会降低,导致可离子化的脂质分子携带正电荷,这会改变LNP的构象,促使mRNA从内体中解脱出来,然后它们就可以与负责生产蛋白的核糖体结合,指导病毒蛋白的合成了。
在mRNA新冠疫苗得到广泛使用之前,美国FDA已经批准过使用LNP技术递送的RNAi疗法。2018年,由Alnylam公司开发的RNAi疗法Onpattro(patisiran)就使用了LNP技术递送治疗遗传性转甲状腺素蛋白淀粉样变性(hATTR)患者的RNAi疗法。不过作为每三周就需要输注一次的疗法,患者仍然需要服用多种抗炎症药物来减少对LNP的不良反应。Alnylam也转向使用偶联技术来开发新一代皮下注射的RNAi疗法。
而辉瑞/BioNTech和Moderna新冠疫苗的成功激发了进一步优化LNP技术的热情。有效的LNP递送技术不但对新的mRNA疫苗开发非常关键,它还具有递送mRNA疗法、基因疗法,以及CRISPR基因编辑疗法的潜力。
除了提高LNP的递送效率和降低LNP的毒性,靶向递送到人体中的特定组织和细胞是这一领域需要克服的下一个挑战。目前,大多数静脉注射的LNP会聚集到肝脏,肌肉注射的疫苗能够被免疫细胞摄入,但是LNP还不能特异性地将药物递送到身体其它部位的大部分组织中。不过近日,由诺贝尔化学奖得主Jennifer Doudna博士联合创建的Intellia Therapeutics公司宣布,该公司开发的LNP能够特异性地将CRISPR基因编辑疗法递送到骨髓中,从而增强对造血干细胞和骨髓细胞的基因编辑。
我们期待LNP技术在mRNA新冠疫苗开发方面的成功能够激发这一领域的进一步突破,促进mRNA疗法、基因疗法以及基因编辑疗法等多种创新治疗模式的开发。
参考资料:
[1] Without these lipid shells, there would be no mRNA vaccines for COVID-19. Retrieved April 27, 2021, from https://cen.acs.org/pharmaceuticals/drug-delivery/Without-lipid-shells-mRNA-vaccines/99/i8
[2] Let’s talk about lipid nanoparticles. Retrieved April 27, 2021, from https://www.nature.com/articles/s41578-021-00281-4
[3] Aldosari et al., (2021). Lipid Nanoparticles as Delivery Systems for RNA-Based Vaccines. Pharmaceutics, https://doi.org/10.3390/pharmaceutics13020206.