如人类一样,细胞也有“生物钟”,会依据自然的“昼夜交替”周期来调节各类蛋白的高低表达,以此控制新陈代谢。然而令人大跌眼镜的是,癌细胞却“偷偷”在“加班”,能够不顾昼夜节律来消耗大量营养物质,加速扩张。
近日,《Nature Communications》上的一项题为Restoration of the molecular clock is tumor suppressive in neuroblastoma的研究报告揭开了癌细胞昼夜节律失调的关键机制。
贝勒医学院的研究人员指出,至少在神经母细胞瘤 (NB)中,较早发现的MYCN癌基因给癌细胞开了“后门”,这类基因的过表达能够调高生物钟抑制因子,从而破坏昼夜节律并让癌细胞成功化身“工作狂”。如果使用激活剂重新恢复细胞生物钟,将抑制肿瘤生长,并使患者对常规化疗治疗变得更敏感。
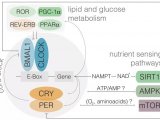
转录因子 BMAL1 是哺乳动物分子钟的主要驱动因素,会伴随昼夜交替调节表达水平从而调控下游基因的有序表达。视黄酸受体相关孤儿受体α(RORα)以及细胞核受体REV-ERBα分别是BMAL1的激活和抑制因子。
在这项试验中,研究人员使用MYCN基因过表达的3组神经母细胞瘤 (NB)患者队列的基因测序数据,探索了MYCN癌基因调节细胞生物钟的背后机制。
在总计超1000名患者间,RORα及BMAL1高表达,即生物钟正常运作的NB患者表现出更好的临床结局,而生物钟抑制因子REV-ERBα过表达的患者临床结果普遍更差。另外,MYCN基因过表达时,RORα和BMAL1的表达水平则遭到抑制,此时生物钟遭到破坏并且患者面临着更糟糕的临床结果。
原发 NB 肿瘤样本中生物钟基因表达的改变以及与不良临床结果的关联
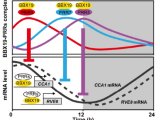
这是否意味着,MYCN能够改变昼夜节律相关基因的表达呢?为了验证这一假设,研究人员检测了MYCN过表达以及沉默时,细胞内RORα和REV-ERBα的表达水平,发现MYCN过表达时,REV-ERBα显着上调,RORα和BMAL1表达显着下降;而在MYCN基因沉默时,情况则相反。另外,增强RORα的活性能够使遭到抑制的生物钟回归正轨。
这些数据表明,MYCN通过调节下调RORα的表达来削弱昼夜节律的影响,而昼夜节律的失衡影响了癌症的治疗效果。既然如此,恢复昼夜节律是否能够抑制癌症的发展呢?
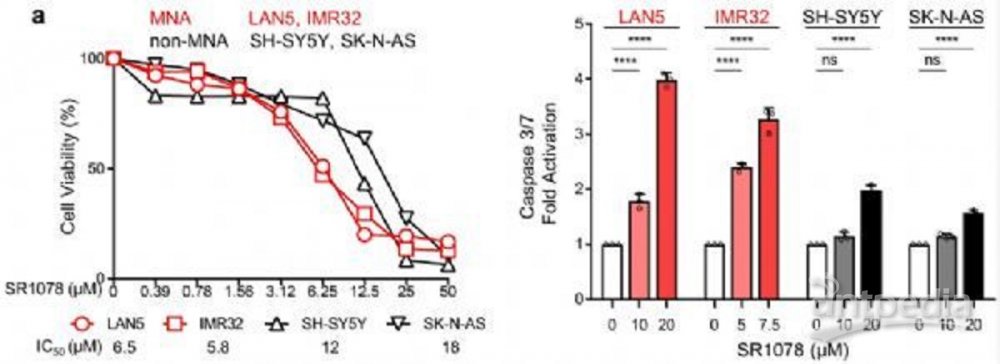
研究人员使用RORα激活剂SR1078对MYCN过表达的细胞进行了处理,发现细胞生长几乎陷入停滞,并且RNA测序结果显示,RORα的激活恢复了BMAL1的表达,并限制了脂肪生成基因的表达,从而抑制了NB细胞存活。这一结果在小鼠模型中被证实,BMAL1表达的恢复抑制了肿瘤的生长。
RORα 激活通过 BMAL1 抑制细胞存活并限制脂肪生成基因表达
值得注意的是,生物钟的恢复不仅限制肿瘤生长,还会提高癌细胞对化疗药物的敏感性。如果将SR1078及常规化疗药物依托泊苷 (VP16)联合使用,原本对VP16不敏感的异种移植小鼠,体内的癌细胞将加速凋亡,说明调节分子生物钟可能是一种可行的癌症疗法。
事实上,早在2015年,《Cell Metabolism》一项研究便提出,癌细胞之所以可以不遵循生物钟,是因为较早发现的一组癌基因MYC基因开了 “后门”,破坏了细胞代谢和昼夜节律。而在这篇新文章中,研究人员则进一步揭示了MYC家族蛋白中的MYCN基因在调节生物钟中扮演的角色,并探索了恢复生物钟的方法。
“恢复BMAL1表达的策略阻止了肿瘤生长,这表明抑制分子生物钟确实会致癌,”贝勒医学院儿科血液肿瘤学助理教授Eveline Barbieri 博士说,“如果能够开发出临床可用的恢复生物钟的药物,或许将为癌症治疗及耐药性问题增加助力。”