近日,中国科学院深圳先进技术研究院医药所高分子中心李洋团队有关新型肿瘤穿透纳米凝胶药物免疫联合疗法的研究成果以Reinforcing the Combinational Immuno-Oncotherapy of Switching “Cold” Tumor to “Hot” by Responsive Penetrating Nanogels为题发表在国际学术期刊ACS Applied Materials & Interfaces上。
肿瘤免疫治疗在临床上取得了不错的进展,但是肿瘤中存在的免疫抑制肿瘤微环境会导致效应淋巴细胞浸润不足、功能耗尽,大幅削弱抗肿瘤免疫效应,促使肿瘤变“冷”,治疗效果远低于预期。因此,设计合理的治疗策略,有效地将“冷”肿瘤转变为效应淋巴细胞活跃的“热”肿瘤,是提高抗肿瘤免疫治疗效果的关键。
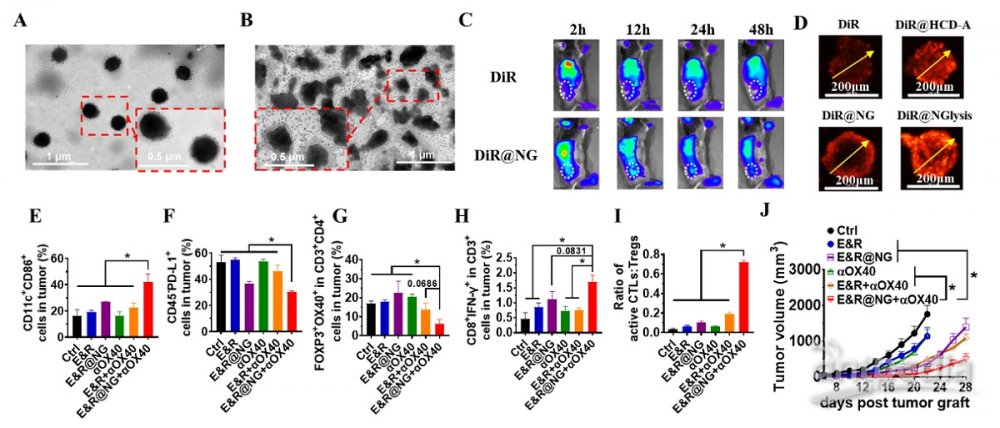
研究团队研发了一种肿瘤微环境响应型深层渗透纳米凝胶药物(E&R@NG)。这种均一、稳定、柔性的纳米凝胶药物可快速富集于肿瘤部位,并在肿瘤微环境下可控释放内部更小尺寸的环糊精-药物包合物,显著改善了免疫调节药物雷西莫特(R848,R)和茶多酚(EGCG,E)在肿瘤部位的富集、渗透与药效。纳米药物在生理条件下可保持完整的球形(图A),进入肿瘤微酸环境时,会破碎释放小粒径环糊精-药物包合物(HCD-A)(图B),从而更有效促使药物在肿瘤部位富集(图C),并穿透到达深部肿瘤(图D)。
纳米药物可与抗体激动剂OX40(αOX40)联合应用,以协同增强树突状细胞(DC)的熟化(图E),降低肿瘤组织免疫检查点PD-L1的表达(图F),解除调节性T细胞(Treg)的免疫抑制功能(图G),最终协同增强细胞毒性T淋巴细胞(CTL)的活化和肿瘤浸润(图H),促使肿瘤中活性CTLs与Tregs的比值增加(20.66倍)(图I),从而成功实现“冷”肿瘤向“热”肿瘤的转变,将肿瘤抑制率提升至91.56%(图J),显著增强了抗肿瘤免疫治疗效果。这一策略还可适用于多种肿瘤免疫治疗方案,有望改善临床上肿瘤免疫治疗有效性欠佳的问题。此新型肿瘤穿透型纳米凝胶在肿瘤免疫治疗方面具有良好的转化与应用前景。
本研究第一作者及共同一作为深圳先进院宋庆乐助理研究员和张国芳助理研究员,通讯作者为深圳先进院李洋副研究员。
图.(A-B)透射电镜图观察E&R@NG分别在正常生理条件(A)和肿瘤微酸条件(B)中的结构响应变化特性。(C)荷瘤小鼠动物模型验证纳米药物肿瘤富集效果。(D)多细胞肿瘤小球模型(赤道平面荧光图像)验证纳米药物在肿瘤中的深层穿透能力。(E)免疫联合疗法增强肿瘤中DC的熟化效果。(F)抑制肿瘤中PD-L1的水平。(G)降低肿瘤中Tregs的免疫抑制功能。(H)促进肿瘤中活化CTL的浸润。(I)改善肿瘤中活化CTLs/Tregs的比值。(J)小鼠肿瘤模型验证抗肿瘤效果得到显著增强。