SARS-CoV-2会引起嗅觉的深刻变化,包括完全丧失嗅觉。尽管这些改变通常是短暂的,但许多COVID-19患者表现出持续数月至数年的嗅觉功能障碍。尽管动物和人体尸检研究已经提出了导致急性嗅觉丧失的机制,但目前尚不清楚SARS-CoV-2是如何导致一部分患者持续丧失嗅觉的。
2022年12月21日,杜克大学Bradley J. Goldstein团队在Science Translational Medicine杂志在线发表题为“Persistent post–COVID-19 smell loss is associated with immune cell infiltration and altered gene expression in olfactory epithelium”的研究论文,该研究分析了从24个活组织检查中收集的嗅觉上皮样本,包括9名在COVID-19后客观量化长期嗅觉丧失的患者。这种基于活检的方法显示了表达干扰素-γ的T细胞弥漫性浸润和髓系细胞群组成的变化,包括CD207+树突状细胞的富集和抗炎M2巨噬细胞的耗尽。
尽管没有检测到SARS-CoV-2 RNA或蛋白质,但嗅觉上皮屏障支持细胞(称为支持细胞)中的基因表达似乎反映了对持续炎症信号的反应,伴随而来的是相对于嗅觉上皮支持细胞的嗅觉感觉神经元数量的减少。总之,这些发现表明,在SARS-CoV-2从组织中消除后很长一段时间内,T细胞介导的炎症仍然存在于嗅觉上皮中,这表明了COVID-19后长期嗅觉丧失的机制。

嗅觉丧失,发生在大多数2019冠状病毒病(coronavirus disease 2019,COVID-19)患者身上,但可能在康复后持续存在。据认为,严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)通过影响鼻腔嗅裂处的嗅觉外周器官嗅觉上皮而导致嗅觉丧失。嗅觉上皮中有负责检测气味的初级嗅觉感觉神经元,由支撑细胞组成的屏障支持细胞层,以及不断更新嗅觉上皮的基底干或祖细胞群。通常,呼吸上皮斑块分布在嗅裂区,由分泌细胞、纤毛细胞和基底细胞组成。嗅觉感觉神经元通过定位于鼻腔内神经元纤毛的嗅觉感受器检测挥发性气味。嗅觉感觉神经元的瞬时基因表达变化、纤毛周围黏液层特征的改变以及炎症被认为会导致SARS-CoV-2感染动物模型的急性嗅觉丧失。
在动物模型和人体解剖组织中的研究表明,该病毒感染的是支撑细胞而不是神经元。与代表原发感染部位的支持细胞一致,UGT2A1/UGT2A2位点的多态性(其基因产物在支持细胞中表达)与COVID-19相关的急性嗅觉或味觉丧失风险升高有关。据认为,在大多数与COVID-19相关的嗅觉丧失患者中,在病毒清除后,正常的上皮修复过程会重建支撑细胞群(以及任何偶然受损的神经元),恢复功能。然而,目前尚不清楚是什么阻碍了患有COVID-19人的恢复与持久的嗅觉功能丧失。
有几种非相互排斥的可能性,包括严重的初始上皮损伤,减少或消除了正常重建神经上皮的基础干细胞池。其他可能包括免疫细胞群对嗅觉上皮细胞的浸润,例如神经炎症或自身免疫现象通过基因表达或其他方式的改变扰乱了正常的嗅觉功能和稳态,或中枢机制导致大脑或嗅觉皮层的嗅球紊乱。对死于COVID-19急性后遗症患者的人体尸检组织进行检查,发现支撑细胞持续感染,嗅觉感觉神经元缺乏感染,上皮解剖完整,嗅觉感觉神经元中存在多种分子变化,这些变化可能导致嗅觉检测的变化,尽管这些患者中没有评估嗅觉。尽管这些发现提示了与COVID-19相关的急性嗅觉丧失相关的机制,但迄今为止,还没有对患有长期嗅觉功能障碍(COVID-19急性后遗症(post-acute sequelae of COVID-19,PASC)的标志性症状)的人的嗅觉组织进行直接检查[包括单细胞RNA测序(scRNA-seq)]。
在这项研究中,研究人员获得了9例持久性PASC相关嗅觉丧失患者的嗅觉上皮活检,并使用免疫组织化学和scRNA-seq鉴定与PASC相关嗅觉功能障碍相关的细胞和转录改变。对照组包括新获得的正常嗅觉上皮活检、粘液样本和我们发表的对照scRNA-seq数据集,共44例患者样本。
通过对患有PASC功能低下的COVID-19患者的嗅觉组织活检进行了分析,这些患者在COVID-19后都表现出了客观测试记录的嗅觉功能障碍。该研究结果比较了来自PASC功能减退患者和正常对照个体的内窥镜引导的嗅觉上皮活检的scRNA-seq数据,提示了一种模式,即免疫细胞和嗅觉上皮之间的相互作用改变了支持细胞和嗅觉感觉神经元的功能变化。
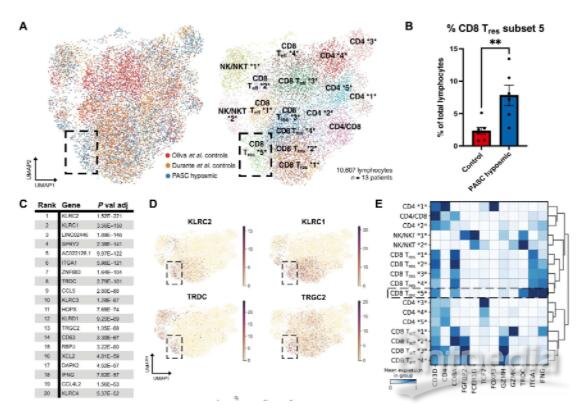
PASC低血症患者鼻嗅上皮活检中CD8+T细胞亚群富集(图源自Science Translational Medicine )
该研究发现与惰性局部免疫细胞反应驱动支撑细胞和嗅觉感觉神经元的表型变化一致。在嗅觉感觉神经元中观察到的变化,包括细胞数量的相对减少,特别是成熟的OMP+神经元,可以解释包括低功能障碍或低功能障碍在内的感觉功能障碍。该研究在PASC相关低血症的背景下观察到嗅觉感觉神经元转录组没有明显的变化,这表明与急性COVID-19病例尸检样本的发现存在一些差异。急性时,局部非自主信号被认为在严重炎症的情况下驱动神经元基因表达的变化。在PASC低嗅觉上皮中,不存在严重炎症,相反,在支持细胞中鉴定了干扰素反应特征,以及表达IFN-γ和γδ T细胞标记的局部淋巴细胞群,这是PASC低嗅觉上皮样本所特有的。
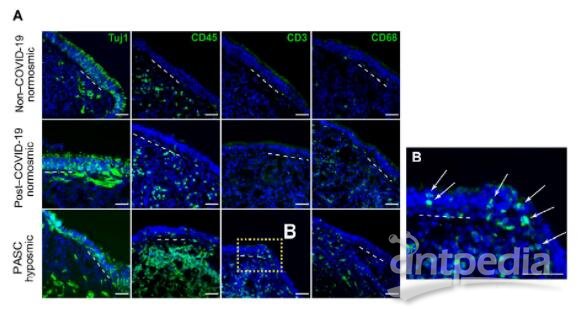
PASC功能减退患者鼻嗅觉上皮活检中T细胞浸润(图源自Science Translational Medicine )
有趣的是,将人类PASC相关嗅觉丧失的表型与先前在急性感染SARS-CoV-2的仓鼠中观察到的表型进行比较。在仓鼠模型中,广泛的免疫细胞(包括巨噬细胞、中性粒细胞和单核细胞)在感染后的头几天浸润上皮细胞,然后在2周内几乎完全溶解。研究人员在SARS-CoV-2感染几个月后观察到人类嗅觉上皮细胞持续浸润,这表明患有PASC功能低下的COVID-19患者可能对先前感染有选择性免疫反应,这与急性免疫反应不同。
此外,该研究数据显示,在PASC下嗅觉上皮中出现了免疫细胞、水平基底细胞、支持细胞和嗅觉感觉神经元之间的失调轴,从而导致感觉功能障碍。这种情况在一部分患者中发生的方式和原因仍有待确定,通过对COVID-19患者巨噬细胞的分析表明,急性SARS-CoV-2感染会导致促炎重编程,这被认为会导致其他免疫细胞功能的长期改变。
该研究提供的数据也与关于SARS-CoV-2感染如何导致长期嗅觉丧失的几个替代机制假设有关。动物模型研究提出的一种可能性是,严重的初始广泛细胞损伤可能会超过基础干细胞重建嗅觉上皮的能力,该研究样本表明,人类嗅觉裂的许多区域拥有由嗅觉感觉神经元、支撑细胞和基底细胞组成的完整的嗅觉上皮。
总的来说,大流行凸显了对嗅觉丧失的新有效治疗方法的需求尚未得到满足。这里提供的机制见解提示了潜在的新的治疗策略。例如,选择性阻断局部促炎免疫细胞或直接抑制特定的信号节点可能会干扰破坏嗅觉上皮稳态或修复的环路。
嗅上皮的位置,在鼻子的嗅觉裂缝,是易于局部局部药物输送,这可能提供了一种手段,以避免系统或脱靶效应的新治疗药物。在动物模型和人类中测试治疗方法的进一步研究,以及对PASC嗅觉功能障碍患者的长期随访,将为嗅觉感觉功能障碍的病因学和管理提供持续的见解。