本文举几例常见的串联质谱仪,篇幅较长分为上、中、下三篇。
串联质谱扫描方式
串联质谱的扫描方式包括以下几种:
1、子离子扫描/产物离子扫描/碎片离子扫描(Product Ion Scan/Fragment Ion Scan):
选择某一质量的母离子进入碰撞室,与碰撞室内的碰撞气体发生解离(CID或HCD),第二个质量分析器进行全扫描,得到的所有碎片离子都是由选定的母离子产生的子离子。如果是离子阱,则是分离出母离子,CID碰撞后,获得所有的子离子谱。同时,离子阱还可获得MS3、MS4等n级的子离子扫描谱。主要用于化合物结构分析。
2、母离子扫描/前体离子扫描(Parent Ion Scan/Precursor Ion Scan):
第二个质量分析器被设定为固定检测某一特定质荷比的子离子,而由第一个质量分析器扫描并检测可经解离产生此特定子离子的所有母离子,可筛检具有相同子结构的同系物,如鉴定多肽上是否含有特定的蛋白质翻译后修饰(PTM),或应用于寻找药物代谢物。
3、中性丢失扫描(Neutral Loss Scan):
两个质量分析器之间以相差一固定质量(即中性碎片质量)进行同步扫描,而仅有在CID过程中丢失此固定质量的离子方可被检测到。因此中性丢失质谱图中显示能产生特定中性碎片的母离子,也就是含有目标官能团的不同分子谱图。
4、选择反应监测(SRM或多反应监测MRM):
串联质谱仪中两个质量分析器均被用于检测所选定的质量而进行扫描。此模式与单级质谱中的选择离子监测(SIM)模式相似,差别在于SRM以第一个质量分析器选择特定母离子,由第二个质量分析器监控特定的子离子,通常是信号强度最高或包含有特征结构新型的子离子。监测多个母离子和子离子,叫做MRM。MRM是定量分析时最常用的方法。
5、DDA和DIA(或SWATH):
在子离子扫描MS/MS时,一般仪器会自动选择执行,常用DDA(Data Dependent Acquisition)和DIA(Data Independent Acquisition)两种数据采集模式。DDA数据依赖采集模式,是最原始最简单的数据采集模式,在进行一级质谱分析后,根据设定的筛选条件(一般为离子强度的阈值Threshold)筛选母离子进行二级质谱分析,可获得更多的碎片信息。该方法筛选目标离子采用的窗口较窄,在一定上可减少干扰离子的存在,但是也会导致一些离子峰强度较高的离子被当成目标离子进行二级质谱分析,从而出现采样不准确、分析重复性较差的情况,因此,不太适合复杂样本的分析。
DIA数据非依赖采集模式(SCIEX称为SWATH),是DDA模式的延伸和发展,DIA主要通过高低碰撞能量进行一级质谱和碎片信息的交替采集,不需要对母离子进行筛选,利用若干个窗口对质谱进行全范围扫描,对每个窗口中的所有离子进行快速、循环选择和检测,理论上可以获得样本中所有离子的全部碎片信息,提高了数据利用度,缺失值更少,分析重复性更高,更适合于大样本和复杂样本的分析检测。
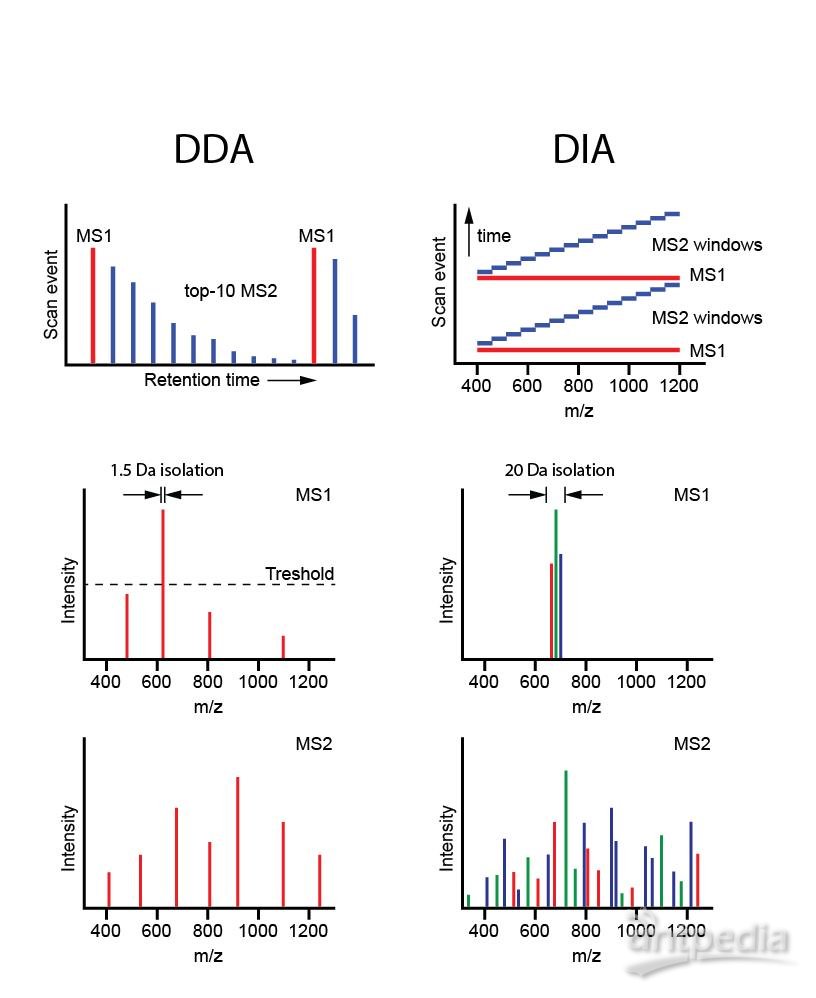
DDA和DIA的区别示意图
6、PRM(平行反应监测,Parallel Reaction Monitoring)
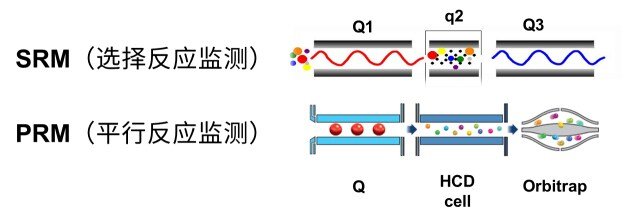
SRM和PRM对比示意图
是目前靶向蛋白质组学数据采集的主流方法,通过对特异性肽段或目标肽段(如发生翻译后修饰的肽段)进行选择性检测,从而实现对目标蛋白质/修饰肽段的靶向相对或绝对定量。PRM是一种基于高分辨、高精度质谱的离子监视技术,能够对目标蛋白质、目标肽段(如发生翻译后修饰的肽段)进行选择性检测,从而实现对目标蛋白质/肽段的定量。首先利用四极杆质量分析器的选择检测能力,在一级质谱中选择性地检测目标肽段的母离子信息。随后,在碰撞池中对母离子进行碎裂;最后利用高分辨、高质量精度分析器在二级质谱中检测所选择的母离子窗口内的所有碎片的信息。这样即可对复杂样本中的目标蛋白质/肽段进行准确地特异性分析。
上述几种是主要的质谱扫描方式,各质谱公司根据各自质谱产品的特定,还会有特定的一些扫描模式,并给以不同的名称。
离子活化/解离模式
获得MS/MS或MSn需要进行离子活化/解离,大部分应用中都用CID,只是蛋白质组等组学应用中需要其它几种模式,解离模式包括以下几种:
1.碰撞诱导解离(Collison-Induced Dissociation,CID)
是最常见的产生碎片离子的方式,在碰撞室或离子阱/FTICR中发生。它包括两个连续步骤:首先是快速移动的离子与目标分子(通常为惰性气体)间的碰撞,离子达到振动激发态;第二个步骤是激发态离子进行自解离的过程。又分为高能CID和低能CID,前者常见于配置磁场、电场分析器或TOF分析器等的串联质谱仪上,后者常用于三重四极杆、离子阱或FTICR串联质谱仪上。
2.高能碰撞解离(High Energy Collision Dissociation, HCD)
HCD专指Orbitrap类仪器中离子在高能碰撞池或多级离子通道中的碎裂方式,相比于CID碎裂方式能获得低m/z的碎片离子,产生的碎片相对更多,谱图质量更高。
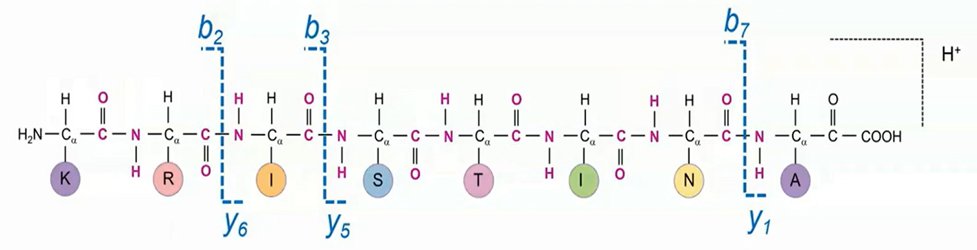
肽段CID/HCD的碎片裂解模式
3.电子捕获解离(Electron Capture Dissociation,ECD)
ECD应用于带正电荷的正离子解离上,正离子与阴极发射出的低能量电子束(常小于0.2 eV)间发生交互作用,多电荷的正离子可通过捕获电子,降低其所带正电荷数并产生自由基正电子进而诱导解离。由于活化过程非常快速,可观察到直接的化学键断裂, ECD仅仅适用于FTICR,因为ECD前离子需位于高密度的热电子环境中。
ECD主要产生由 N—C α键的断裂而形成的 c 和 z 类型离子;由于骨架键的断裂发生在振动能量重新分布之前,ECD可以很好地保留非共价键以及弱的翻译后修饰键信息;同时ECD的断裂位点只取决于电子捕获的位点而不考虑分子键能的高低,可以产生的碎片离子更加丰富,可与CID/HCD碎裂模式形成互补。
4.电子转移解离(Electron Transfer Dissociation, ETD)和电子活化解离(Electron Activated Dissociation, EAD )
ETD、EAD的碎裂行为和ECD类似,都是主要生成c、z离子。其中ETD模式在离子阱中将一个电子从引入的阴离子基团转移到肽阳离子上引起肽段碎裂,因此称之为电子转移解离;带负电的蒽离子(Anthracene Anion)与偶氮苯离子(Azobenzene Anion)最常被用于ETD。
相比于传统的CID/HCD解离,ECD/ETD/EAD可以降低蛋白酶解的依赖性,能够很好地裂解带有更高电荷的大片段肽段和完整蛋白,得到几乎完全断裂的肽段,也能获得丰富的c、z序列离子,并且保留蛋白质或肽段上带有的修饰基团,如磷酸化修饰、N-和O-糖基化修饰、磺化修饰等,对蛋白质翻译后修饰和Top-down蛋白质组学研究起到了有利的推动作用。
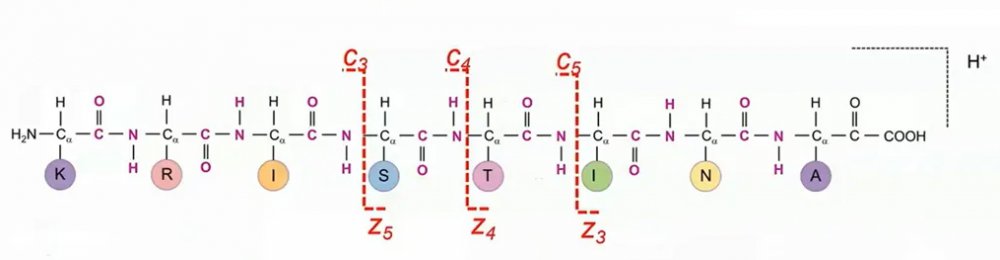
ECD/ETD/EAD的碎片裂解模式
然而该种模式解离带有高电荷大片段肽段和完整蛋白时,得到的碎裂肽段带电荷一般很高,谱图复杂难以解析,在ETD反应体系中加入能与高电荷肽段发生质子转移电荷减少反应(Proton Transfer Charge Reduction,PTCR) 的阴离子,将高电荷的解离产物转化为较低电荷态,简化谱图有助于谱图解析,PTCR技术也已用在成熟的商品化质谱仪中,如赛默飞三合一仪器——Orbitrap Eclipse和Orbitrap Ascend,这两款仪器用于质子转移的阴离子为全氟 (十四氢菲)离子。
接下来请见下篇:液质联用中的质谱:检测器
目录:
前言:液质联用(LC-MS)简述
Chapter1、液质联用中的液相色谱
Chapter2、液质联用中的质谱
2.1离子源
2.2离子传输
2.3 质量分析器
2.4串联质谱(Tandem Mass Spectrometry,MS/MS)
2.5 检测器
2.6 真空系统
Chapter3、液质联用中的数据采集和分析