近日钟南山团队发布的一项国际多中心研究表明,连花清瘟胶囊对轻至中度新冠肺炎(COVID-19)患者的症状恢复显示出显著效果。该研究在中国、泰国、菲律宾和越南的17个研究点进行,共纳入410名接受连花清瘟治疗的患者和405名接受安慰剂治疗的患者。
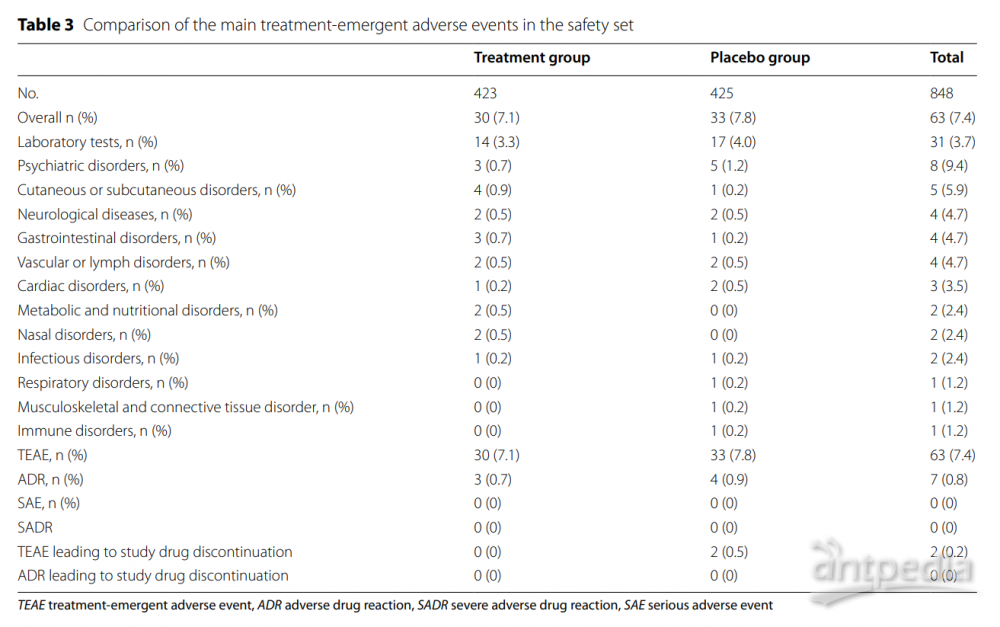
研究结果显示,连花清瘟胶囊能显著缩短患者的主要症状恢复时间,包括鼻塞或流涕、喉咙痛、咳嗽、发热感或发热、低能量或疲劳以及肌肉痛。相比之下,在呼吸急促、头痛、寒战或发抖方面的差异并不显著。此外,该药物在安全性方面与安慰剂组相当,研究中没有报告任何严重不良事件。

该研究的引言部分指出,由于SARS-CoV-2病毒的不断演变和新变种的出现,新冠肺炎疫情仍然是全球性的健康挑战。特别是奥密克戎变种的传播能力增强,使得有效的治疗方法需求迫切。连花清瘟胶囊,作为中医药配方之一,在体外实验中显示出抑制SARS-CoV-2复制和抗炎作用。
该研究的方法部分描述了严谨的试验设计,包括双盲随机对照试验、广泛的地理覆盖范围以及严格的入选和排除标准。研究所用的随机分组和盲法确保了结果的客观性和可靠性。
研究讨论部分强调,尽管存在样本量不平衡和观察期限较短等局限性,但研究结果显示连花清瘟胶囊对轻至中度新冠肺炎患者具有显著的疗效。特别是在目前市场上缺乏针对此类患者的低成本药物的背景下,连花清瘟胶囊的发现为社区内的患者管理提供了新的可能性。
以下是该研究的主要内容:
研究背景:新冠肺炎是一种全球大流行病,而连花清瘟胶囊是一种中药配方,被用于治疗新冠肺炎。然而,之前的临床证据水平有限。
研究目的:评估连花清瘟胶囊对轻至中度新冠肺炎成年患者的疗效和安全性。
研究方法:在中国、泰国、菲律宾和越南的17个研究点进行了一项双盲随机对照试验,包括410名接受连花清瘟胶囊治疗的患者和405名接受安慰剂的患者。患者接受治疗或安慰剂共14天,主要终点是九个主要症状持续临床改善或消失的中位时间。
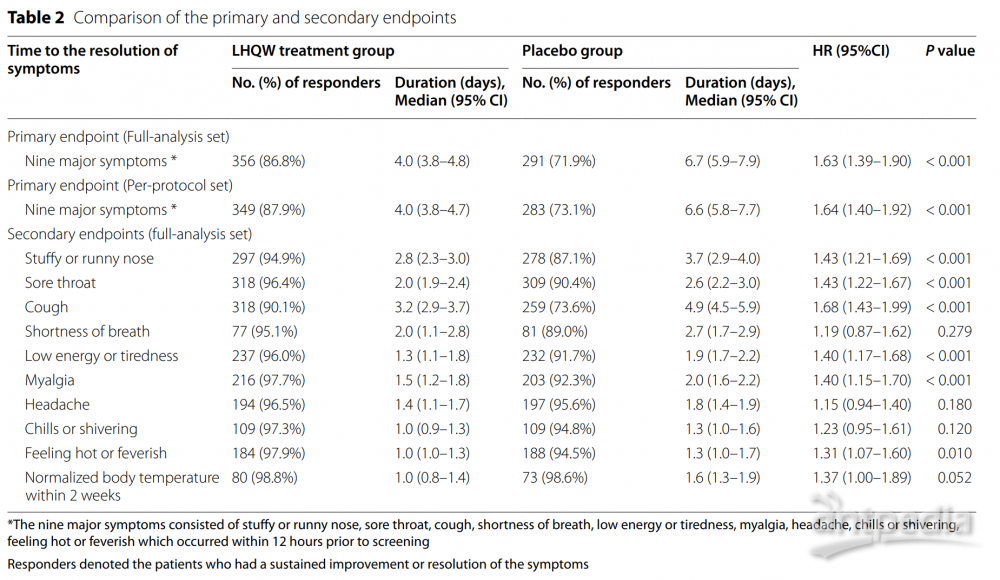
主要结果:连花清瘟胶囊显著缩短了主要终点时间(4.0天对比6.7天),包括鼻塞或流涕、喉咙痛、咳嗽、发热或感觉发热、低能量或疲劳和肌痛的中位时间。两组在安全性方面没有显著差异,没有报告严重不良事件。
讨论:这项研究证实了连花清瘟胶囊对轻至中度新冠肺炎成年患者的疗效和安全性,对于减轻症状负担和避免疾病进展为重症或危重病具有潜在价值,特别是在奥密克戎变种流行的情况下。
总之,这项研究提供了连花清瘟胶囊作为新冠肺炎治疗的一种潜在选择的证据,特别是对轻至中度病例。然而,研究也存在一些局限性,例如观察期相对较短以及样本量不平衡等。需要进一步的研究来验证这些发现并更全面地评估连花清瘟胶囊的疗效和安全性。
原文附件:
以下是Paper中文翻译的原稿:
背景:在一项随机试验中,连花清瘟(LHQW)胶囊对新冠肺炎(COVID-19)患者的症状恢复显示出效果,但由于缺乏盲法设计和样本量有限,其临床证据水平较低。
目的:评估连花清瘟胶囊对轻至中度新冠肺炎成年患者的疗效和安全性。
方法:我们在中国、泰国、菲律宾和越南的17个研究点进行了一项双盲随机对照试验,对象为轻至中度新冠肺炎成年患者。患者接受常规治疗或加服连花清瘟胶囊(每次4粒,每天三次)共14天。主要终点是九个主要症状持续临床改善或消失的中位时间。
结果:全分析集包括410名接受连花清瘟胶囊治疗的患者和405名安慰剂组患者。连花清瘟显著缩短了全分析集的主要终点时间(4.0天对比6.7天,危险比:1.63,95%置信区间:1.39-1.90)。连花清瘟胶囊缩短了持续临床改善或消失的中位时间,包括鼻塞或流涕(2.8天对比3.7天)、喉咙痛(2.0天对比2.6天)、咳嗽(3.2天对比4.9天)、发热或感觉发热(1.0天对比1.3天)、低能量或疲劳(1.3天对比1.9天)和肌痛(1.5天对比2.0天)。两组在持续临床改善或消失的呼吸急促、头痛、发冷或寒颤方面没有显著差异。两组的安全性相当。没有报告严重不良事件。
引言:引起新冠肺炎(COVID-19)的严重急性呼吸综合征冠状病毒2(SARS-CoV-2)在全球范围内不断演变。Omicron变种的传播能力大幅增加,与祖先毒株和现有变种相比,其在下呼吸道的致病性降低。除发热和疲劳外,Omicron变种引发的呼吸症状(例如咳嗽、呼吸急促)显著降低了生活质量,并在易感人群中引起了大量的发病率和死亡率。为了减少症状负担和进展为重症或危重病的可能性,已经开发了几种治疗方法。这些主要包括抗病毒药物(例如nirmatrelvir-ritonavir、monulpiravir、VV116)、单克隆抗体(例如tixagavimab-cilgavimab、sotrovimab、tocilizumab)和抗炎药物(例如baricitinib、tofacitinib)。
对于在家庭或社区管理的轻至中度疾病患者,目前市面上缺乏成本较低的用于缓解症状的药物。中国卫生部《新冠肺炎诊疗方案》(第10版)推荐了几种中医药配方用于临床应用。据报道,连花清瘟胶囊在体外抑制了SARS-CoV-2的复制,并具有抗炎作用——在mRNA水平上抑制了促炎细胞因子(肿瘤坏死因子-α、白细胞介素-6、C-C基序配体-2/巨噬细胞趋化蛋白-1和CXC基序趋化因子-10/诱导蛋白-10)的产生。在一项案例系列观察性研究中,连花清瘟显著改善了主要症状并加速了COVID-19患者的恢复。在一项涵盖284名感染祖先毒株的患者的随机对照试验中,连花清瘟(每次四粒,每天三次)治疗14天,临床恢复率显著高于对照组(91.5% 对比 82.4%,P=0.022),加速了症状恢复(中位数:7天对比10天,P<0.05)。
【方法 研究设计与受试者】
FLOSAN试验招募了中国12家医院、泰国3家医院以及越南和菲律宾各一家医院的轻至中度新冠肺炎患者,时间为2022年2月至12月(附加文件1:表S1)。该研究的完整协议已近期发表(详情见在线补充材料)[16]。简要来说,符合条件的患者年龄在18-70岁之间,根据世界卫生组织标准被诊断为轻至中度新冠肺炎[17],通过快速抗原测试(RAT)或核酸扩增测试(NAAT)检测呈阳性,症状发作至筛查间隔不超过4天,且在筛查前12小时内至少出现三种主要症状(鼻塞或流涕、喉咙痛、咳嗽、呼吸急促、低能量或疲劳、肌肉痛、头痛、寒战或发抖、发热或感觉发热)。我们排除了以下患者:(1) 已知的其他感染并发症;(2) 未得到良好控制的全身性疾病;(3) 过去一年内有酒精或药物滥用;(4) 近一个月内参与其他试验;(5) 怀孕、哺乳或产后两周内。FLOSAN试验符合赫尔辛基宣言。每个参与地点的伦理委员会根据良好临床实践准则批准了该试验。所有患者均已签署书面知情同意书。
【随机分组和盲法】
我们随机将患者(1:1)分为接受连花清瘟或相匹配安慰剂(由石家庄伊灵制药有限公司,中国石家庄生产)的治疗组,随机数字由SAS软件包(SAS Inc.,美国北卡罗来纳州卡里)生成。区块大小为4,无分层。在竞争性招募方案下,分站调查员按升序分配患者。研究药物的颜色、气味和外观相同,只是安慰剂不含连花清瘟的任何活性成分。患者、研究调查员和其他工作人员在数据库锁定前对治疗分配情况不了解。
【程序】
随机分组后,患者在指定医院(中国大陆)住院期间或门诊招募期间(菲律宾、泰国和越南)服用连花清瘟(每粒0.35克,每日三次,共4粒)或相匹配的安慰剂连续14天。两组均接受包括解热药、止痛药、营养补充和液体替代在内的标准护理。当体温达到38.5度或以上时,可以使用非甾体抗炎药物或扑热息痛来缓解发热。禁止使用抗病毒药物或含有连花清瘟核心成分的药物。各地点可以遵循其国家和地区的当地指南和协议。患者在中国大陆的住院或在泰国、越南和菲律宾的门诊进行四次随访(第3天、7天、10天和通常安排在第14天的研究结束访问)。因症状恢复加速或其他原因提前中断治疗的患者可以参加所有计划的访问。在研究期间,患者被要求每天两次填写日记卡以评估症状的变化。
【结果】
主要终点在第14天评估——上述九个主要症状持续临床改善或消失的中位时间,评为轻微或等于轻微(评分为1或0)且持续稳定超过24小时(详见补充文件中的症状日记卡)。预设的次要终点包括在第14天有持续改善或消失九个主要症状的患者比例,每种个别症状持续改善或消失的中位时间,解热效果开始和体温恢复正常(腋下温度≤37.0°C或口温≤37.3°C超过24小时)的中位时间,持续改善或消失胃肠道症状、失味和味觉减退的中位时间,所有症状持续改善或消失的患者比例,NAAT检测结果转阴的时间和转阴率(第0、7、10、14天),胸部影像学明显改善的患者比例,COVID-19相关的重症/危重病例发生率,14天内COVID-19相关和所有原因的死亡率。由一位经验丰富的放射科医师(对研究分配情况不了解)回顾胸部X光或计算机断层扫描(CT)影像并评估结果。胸部放射学改善表示浸润区域减少、任何放射学异常区域减少或地玻璃影或结节密度减少[15]。从首次给药至随访结束,对安全终点进行评估,包括生命体征、体格检查、实验室检测的主要变化、异常的十二导联心电图结果,以及不良事件(AE)和严重不良事件(SAE)。详情见在线补充材料。
【统计分析】 假设对照组持续改善或消失的中位时间为12天,连花清瘟组为9天,根据PASS软件计算,将652名患者以1:1的比例随机分配到连花清瘟或安慰剂组,以达到95%的统计功效,双侧显著性水平为0.05。实际中,在考虑到RAT结果的情况下,招募了患者,每组需要344名患者,假设95%的RAT阳性患者会产生阳性的NAAT结果。考虑到20%的退出率,需要招募860名患者。我们使用SAS 9.4软件(SAS Institute,北卡罗来纳州卡里)进行统计分析。所有随机分配且至少服用过一次研究药物且根据NAAT确诊为COVID-19的患者均包含在全分析集中。完全遵守协议的患者(遵守度:80%或更高)被纳入按方案分析集。我们优先展示全分析集的数据。主要终点采用Log-rank检验进行分析,并用Kaplan-Meier曲线展示。事件发生时间以中位持续时间和95%置信区间(CI)呈现。临床事件的风险比(HR)得以展示。我们使用卡方检验或Fisher精确概率模型分析了以下终点,包括症状缓解的患者比例、病毒排出减少(截止于第14天)、胸部影像学显著改善、重症和危重疾病、死亡和所有原因死亡。我们还用与主要终点相同的分析策略分析了单一症状持续缓解的中位时间、发热缓解、消化系统症状、失味或味觉减退以及所有临床症状的缓解,以及病毒排出的持续时间。我们根据国籍、性别、年龄、疫苗接种状态、合并抗病毒药物或其他中药复方使用情况以及症状发作至随机分配的持续时间,对主要终点进行了事后亚组分析。FLOSAN试验已在中国临床试验注册中心注册(编号:ChiCTR2200056727)。CONSORT检查表可在补充文件中找到。资助来源的作用:赞助商参与了研究设计、主要调查员、研究药物提供和数据收集。一个独立的第三方参与了数据分析。第一作者和通讯作者完全掌握数据,通讯作者决定提交稿件发表。
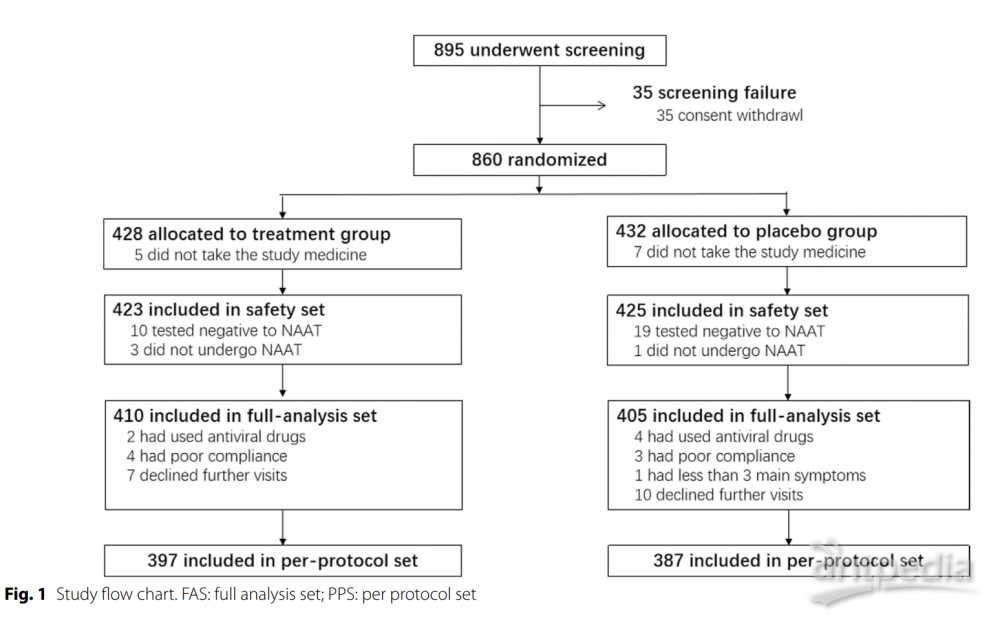

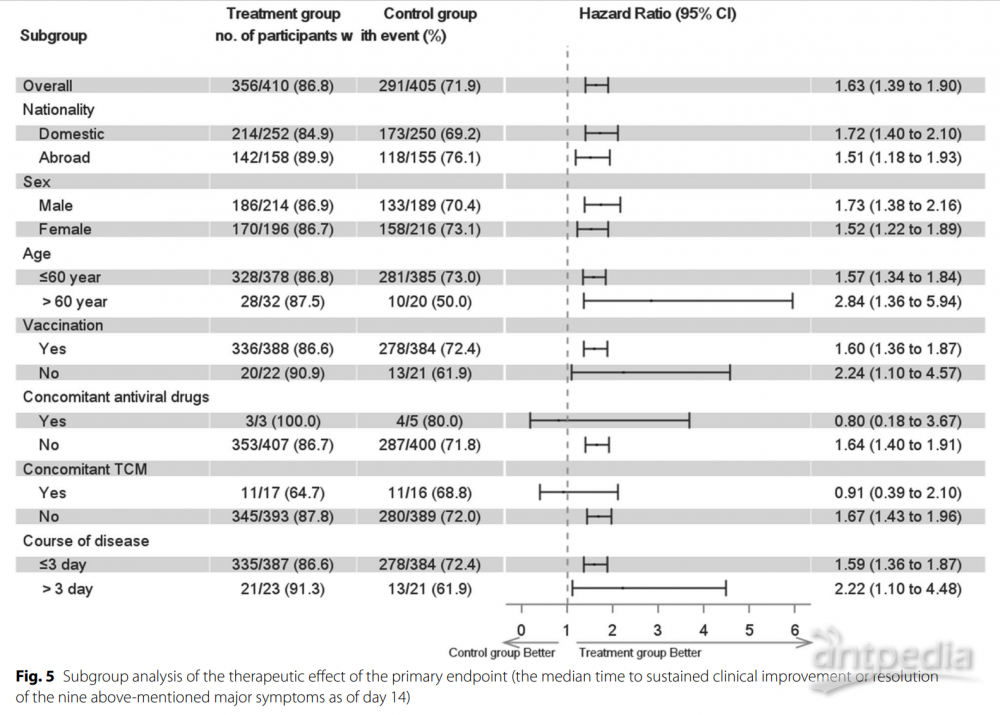
研究流程图如图1所示。在895名患者中,35名撤回同意,33名未进行或NAAT检测阴性(附加文件1:表S2)。最终,全分析集包括410名治疗组和405名安慰剂组患者,按方案分析集包括397名治疗组和387名安慰剂组患者。患者按国家分布情况见附加文件1:表S3。LHQW组和安慰剂组分别有93.2%和95.1%的患者遵守度在80-120%。整体上,患者平均年龄为37岁,性别分布均衡。61.1%的患者来自中国大陆,其次是泰国(28.2%)。越南和菲律宾分别有43名和21名患者。89.2%的患者接种了完整疫苗。最常见的症状是咳嗽(86.5%),其次是喉咙痛(82.5%)和鼻塞或流涕(77.5%)。只有21.1%的患者出现呼吸急促。两组在全分析集(表1)和按方案分析集(附加文件1:表S4)中的人口特征、症状和疫苗接种状态均相似(所有P>0.05)。两组患者中Charlson共病指数大于2.0的比例无显著差异。两组在入组前的疫苗接种水平基本相当。LHQW治疗显著缩短了全分析集中的主要终点时间(4.0天对比6.7天,HR: 1.63,95% CI 1.39–1.90)和按方案分析集(4.0天对比6.6天,HR: 1.64,95% CI 1.40–1.92)(图2)。LHQW组的曲线从第2个月开始与安慰剂组分离。在全分析集中,LHQW组有显著更高比例的患者在14天内实现主要症状消失(86.8%对比71.9%,P<0.001)。这些发现在按国家、性别、年龄区间、先前接种疫苗、合并使用其他中药或症状发作至随机分配的持续时间分层时依然稳健(附加文件1:表S5)。
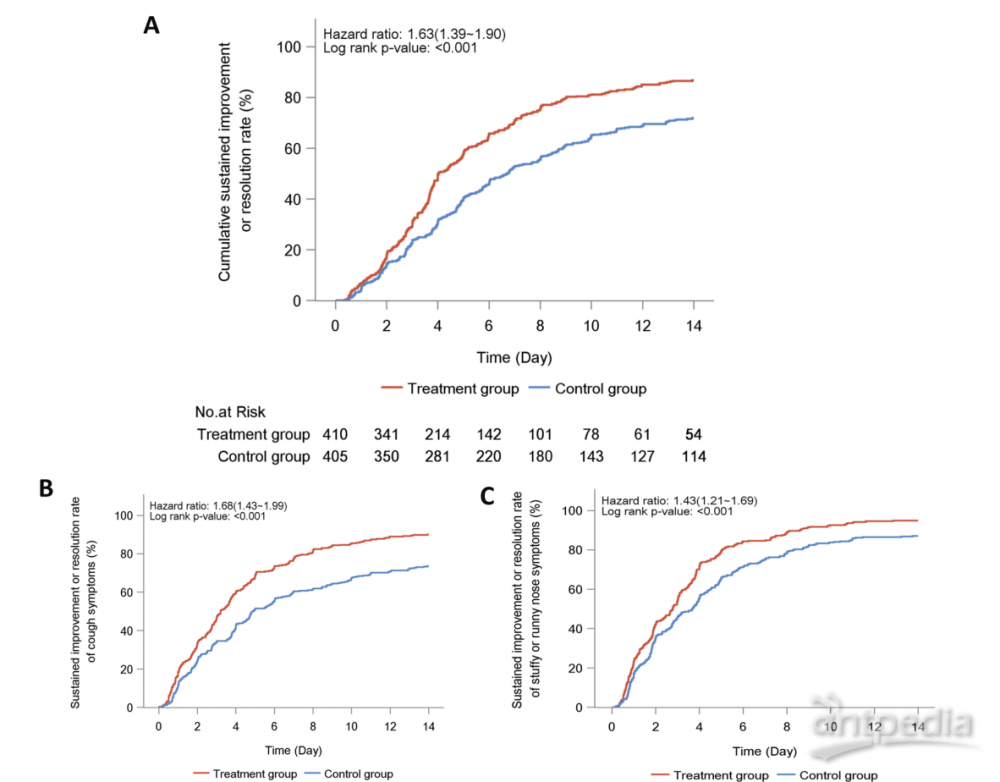
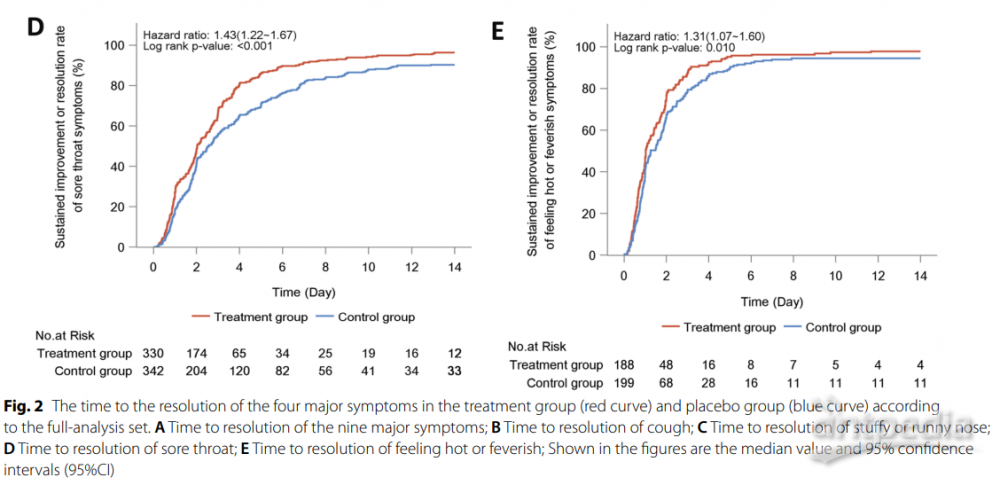
此外,按方案分析集中14天内实现主要症状消失的患者比例的发现并未发生实质性改变(87.9%对比73.1%,P<0.001)(附加文件2:图S1)。个别主要症状消失的时间见表2。连花清瘟与明显较短的持续改善或消失的中位时间相关,包括鼻塞或流涕(2.8天对比3.7天,HR:1.43,95% CI:1.21-1.69),喉咙痛(2.0天对比2.6天,HR:1.43,95% CI:1.22-1.67),咳嗽(3.2天对比4.9天,HR:1.68,95% CI:1.43-1.99)和发热感或发热(1.0天对比1.3天,HR:1.31,95% CI:1.07-1.60)(图2),低能量或疲劳(1.3天对比1.9天,HR:1.40,95% CI:1.17-1.68)和肌肉痛(1.5天对比2.0天,HR:1.40,95% CI:1.15-1.70)。然而,呼吸急促(2.0天对比2.7天,HR:1.19,95% CI:0.87-1.62),头痛(1.4天对比1.8天,HR:1.15,95% CI:0.94-1.40)和寒战或发抖(1.0天对比1.3天,HR:1.23,95% CI:0.95-1.61)的时间差异不显著(图3)。类似的发现也适用于按方案分析。
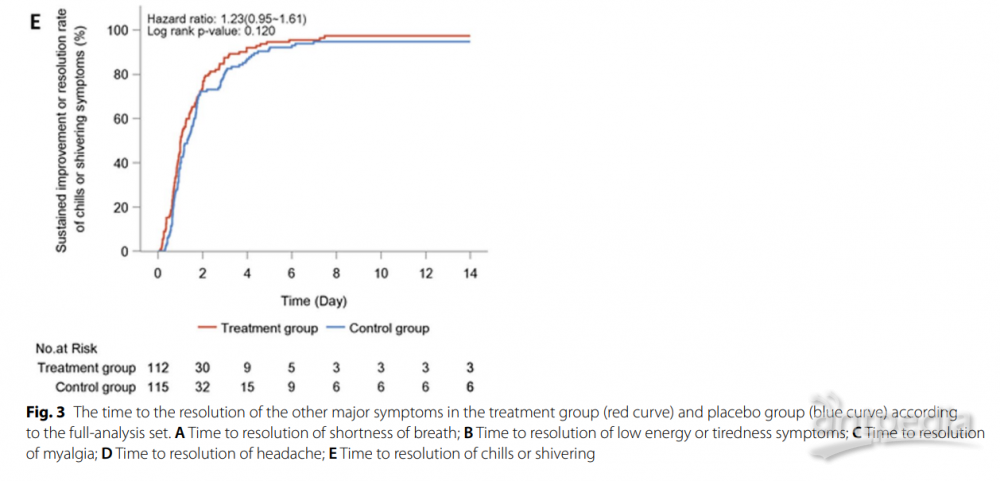
此外,连花清瘟组在持续改善或消失的失味和味觉减退(2.7天对比3.6天,HR:1.21,95% CI:0.89-1.64)或胃肠道症状(1.7天对比1.8天,HR:1.17,95% CI:0.89-1.54)方面的时间并没有显著差异,尽管体温恢复正常的时间略短(1.0天对比1.6天,HR:1.37,95% CI:1.00-1.89)(附加文件1:表S6;附加文件3:图S2)。然而,连花清瘟组有更多患者实现了所有症状的持续改善或消失(85.1%对比71.1%,P<0.05)(图5)。
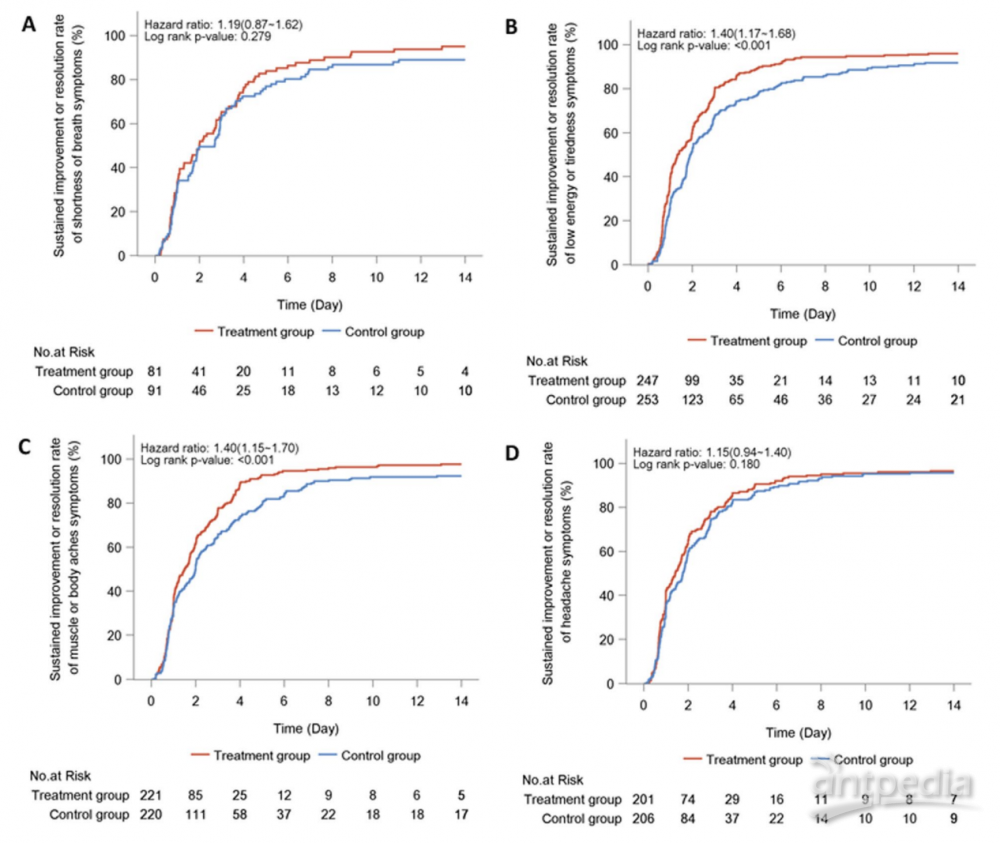
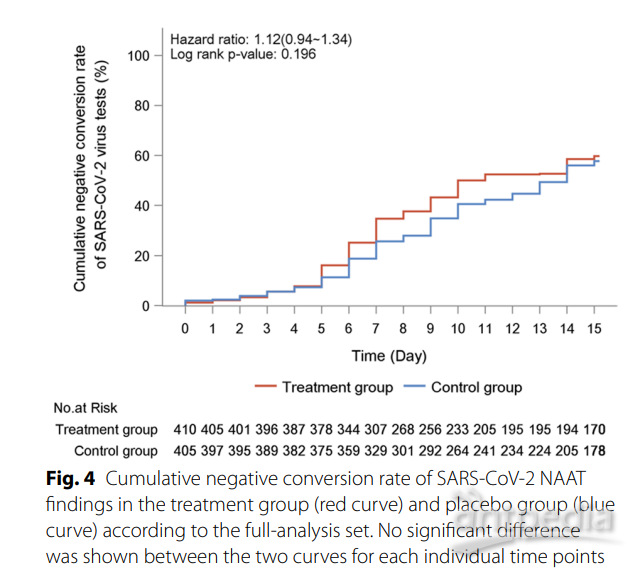
【讨论】 FLOSAN研究是首个国际多中心随机对照试验,评估了西太平洋地区轻至中度新冠肺炎患者使用连花清瘟胶囊的安全性和有效性。连花清瘟14天的治疗显著缩短了大多数主要症状和所有症状综合的持续改善或消失时间。连花清瘟并未显著加速NAAT检测结果的转阴。没有患者进展为重症或危重疾病,也没有患者死亡。连花清瘟具有良好的耐受性(附加文件2和3)。研究设计中更大的科学严谨性使FLOSAN研究的发现与我们之前发表的多中心随机研究的主要结果一致[15]。FLOSAN研究中症状消失的中位时间差异可能主要是由于不同的病毒株(奥密克戎变种对比祖先毒株)和疫苗接种状态(部分/完全接种对比未接种)所致。尽管两组在主要有效性终点上的差异未达到我们预定义的水平(3.0天),但对于大多数可能影响生活质量的主要症状,治疗效果大体一致。这对于由奥密克戎变种引发的呼吸症状更为明显,该变种对上呼吸道上皮的结合亲和力高[18]。我们的发现与其他关于使用中药治疗新冠肺炎的已发表研究一致。几个不同样本大小和设计的荟萃分析得出了连花清瘟胶囊对轻至中度新冠肺炎的治疗益处[19]。这些主要包括临床恢复率提高、进展为重症或危重疾病的可能性降低以及与对照组相比的相似安全性。我们的研究无法评估连花清瘟预防疾病进展的效果,可能是因为我们招募的患者感染了奥密克戎变种,与我们之前多中心试验中招募的患者相比,他们整体年轻且没有多重并发症[20-22]。尽管另一项研究表明连花清瘟在感染者密切接触者中具有预防效果[23],并且体外研究已证明其抗病毒效果[13],但本研究并未表明连花清瘟胶囊在加速病毒清除方面有任何治疗效果。在COVID-19患者中,连花清瘟胶囊安全性良好,与安慰剂组相比具有相似的安全性,这与我们[15]和其他研究的发现相符[23]。不良事件(AE)和治疗相关的AE的谱系并未显示与连花清瘟相关的额外主要安全信号。没有患者报告严重不良事件(SAE),再次确认了临床应用的安全性。主要优势包括国际多中心试验招募了来自西太平洋地区四个国家的大量患者样本,各国之间在治疗反应和安全性方面没有显著差异。因此,这些发现可能适用于亚洲患者。与匹配安慰剂的双盲研究设计为连花清瘟胶囊的有效性提供了更坚实的证据。在奥密克戎爆发期间进行的现有市场药物的临床试验很少,而我们的试验就是在此时启动的。我们的发现进一步验证了连花清瘟胶囊对奥密克戎变种的有效性,这是目前全球流行的SARS-CoV-2主要变种。
这一点非常重要,因为在中国大陆,市场上缺乏药物,而且存在大量易感人群。一些已经上市的具有显著治疗潜力的重新利用草药,连花清瘟胶囊可能有助于减轻奥密克戎疫情高峰期间社区居住的轻至中度新冠肺炎患者的医疗负担。也应考虑一些局限性。首先,各个国家内的样本量存在不平衡,尽管我们没有发现表明各国之间存在差异治疗反应的迹象。然而,当按国家分层(中国对比其余国家组合)时,我们的发现在主要研究结果上没有实质性改变。其次,相对较短的观察期无法提供连花清瘟长期疗效的进一步证据(例如第28天或更长时间)。第三,当将我们的结论推广到其他人群(如有多种并发症或免疫抑制的人群)时应谨慎行事。此外,我们的研究无法直接解释连花清瘟治疗COVID-19的分子机制。最后,我们没有采用分层随机化方案。然而,随机分组在可能影响研究结果的不同指标(例如性别、年龄、症状持续时间、疾病严重程度)上保持平衡。鉴于研究地区和研究地点的差异,我们采用了中心区块随机化方案,结果显示人口统计学和其他基线疾病严重程度指标的分布平衡。
【结论】 连花清瘟胶囊对轻至中度新冠肺炎有效且安全,通过加速症状缓解和临床恢复。对于现在可以在社区内管理的患者,连花清瘟可能是值得考虑的。
篇幅原因省略Reference...,可下载原文附件查看: