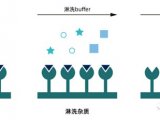
核酸亲和层析
| 实验材料 | |
|---|---|
| 试剂、试剂盒 | |
| 实验步骤 | 在上样品液到核酸亲和柱之前,建议首先采用其他的纯化方法,如硫酸铵沉淀、离子交换或凝胶过滤层析等富集目的蛋白。这样可以除去绝大多数的污染物,并减少非特异结合。亲和层析柱一般来讲是短而粗的,例如长宽比为 2:1。 1. 10 倍柱体积的平衡缓冲液(20 mmol/L,pH 8.0 Tris-HCl,0.15 mol/L KCl,1 mol/L EDTA)平衡柱; 2. 调整样品液到相似的离子浓度(即 0.15 mol/L KCl); 3. 加非特异 DNA 到样品液内,每 ug 纯蛋白质加 100 ng。混匀后在冰上孵育 10 min。非特异 DNA 长度通常是 1 kb 左右,可以是 poly(dI-dC)或 poly(dA-dT),也可以是超声破碎的大肠杆菌、牛胸腺或鲑鱼精 DNA。为了除去孵育后可能形成的复合物,需 10 000×g 离心 10 min 弃去沉淀; 4. 缓慢地将样品液上样到亲和柱,流速 15 ml/h; 5. 5 倍体积平衡缓冲液洗柱; 6. 分别用 1 倍体积各含 0.2、0.3、0.6 和 1.0 mol/L KCl 的平衡缓冲液洗脱目的蛋白; 7. 检测各收集组分的活性,并汇集有特异活性的组分。因为蛋白质浓度时常较低,故常加入非离子型去垢剂 Triton X-100(终浓度 0.05%)以减少容器壁对蛋白质的吸附。需要注意的是该去垢剂会干扰 A280 测定; 8. 在 -70℃ 储存活性目的蛋白组分; 9. 用 10 倍体积的含 2.5 mol/L NaCl 和 0.5 mol/L EDTA 的平衡缓冲液洗柱使亲和柱再生。然后用含 0.02% NaN3 的平衡缓冲液再平衡后将柱 4℃ 储存。 |