病例资料
患者男,19岁,因“反复乏力3年,腰痛伴活动受限2年”入院。
患者3年前无明显诱因出现双下肢乏力,近端明显,活动后为甚,休息可缓解,未予处理,症状进行性加重,于2年前出现上楼梯费力,伴腰部酸痛及活动受限,晨起为甚,并晨僵,每日持续约30 min,活动后可缓解。
1年前出现下蹲后起立困难,伴双上肢近端乏力,曾于外院使用中药治疗,效果欠佳,四肢乏力、腰痛及活动受限进行性加重。
既往史、个人史、婚育史及家族史均无异常。
查体:生命体征平稳,全身皮肤未见皮疹,浅表淋巴结未及肿大,心肺腹查体未见异常。四肢各关节未见肿胀及压痛。腰椎活动轻度受限,颈部活动无受限。双侧4字试验阴性。指地距15 cm,枕墙距0 cm,改良Schober试验4 cm。双上肢肌力5锻,双下肢肌力4级,肌张力正常且对称。
入院后完善检查:血常规、尿常规、大便常规及凝血功能未见异常。
实验室检查:ALT 306 U/L、AST508 U/L、CK2 780 U/L、LDH 971 U/L、CK.MB 47.9 U/L、免疫球蛋白(Ig)G23.1 g/L、IgA 3.74 g/L、IgM 3.74 g/L、补体C3 1.36 g/L、补体C4 0.23 g/L、CRP 0.7 mg/L。肾功能、血脂、血清电解质及血糖无异常。ESR 7 ram/1 h。
甲状腺功能:游离三碘甲状腺原氨酸(T3)4.02 pinol/L、游离甲状腺素(T4)19.22 pinol/L、促甲状腺素(TSH)2.89 uU/ml,均无异常。
肿瘤指标:甲胎蛋白0.76 ng/n、癌胚抗原1.06 ng/ml、糖链抗原19—9 2.42 kU/L、血清铁蛋白99.95 ng/ml,均无异常。ANA、抗dsDNA抗体、ENA系列及RF均无异常,HIA—B27阴性。
全脊柱、骨盆及骶髂关节x线未见异常。心电图、心脏及腹部彩色多普勒超声均未见异常。
核磁共振检查提示:双侧骶髂关节无异常。
肌电图提示:肌源性损害。
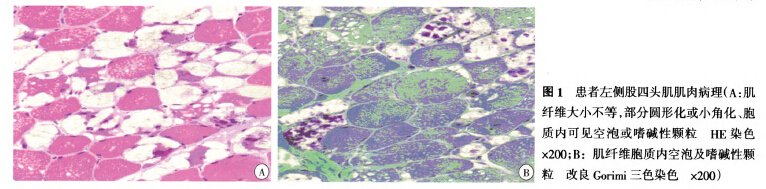
左侧股四头肌肌肉活检术及病理检查[苏木精-伊红(HE)染色,图la]见骨骼肌组织及肌束结构尚存;肌纤维大小不等,可见圆形化或小角化肌纤维;胞质内可见空泡及嗜碱性颗粒;胞核内移;未见明显肌纤维坏死及再生肌纤维。
患者拟诊:①PM;②脊柱关节炎待排除,一方面将肌肉及血液样本送外院行病理学及遗传学检查以进一步排除其他肌病,另一方面使用甲泼尼龙(40 m洲)联合甲氨蝶呤(每周7.5 mg)诊断性治疗。
用药后患者腰痛好转,但四肢乏力及腰部活动受限无改善,多次复查CK波动于。773-1415 U/L、AST波动于152-483 U/L。
送检肌肉样本病理结果回报:HE染色所见同前、ATP酶染色见2型肌纤维胞质内均可见空泡、改良Gorimi三色(MGT)见肌纤维胞质内空泡及嗜碱性颗粒(图1b)、高碘酸-希夫染色(PAS)见肌纤维胞质空泡化伴糖原沉积、油红O染色(ORO)未见脂质沉积、抗肌萎缩蛋白免疫组织化学染色阳性,病理诊断为肌源性损害,考虑糖原贮积症Ⅱ型(GSDⅡ)可能性大。
外院遗传学检查发现α-葡萄糖苷酶(GAA)基因c.1634C>T杂合、c.1843G>A杂合,符合GSDⅡ基因型。患者修正诊断为GSDⅡ伴强直脊柱综合征(RSS),减停甲泼尼龙及甲氨蝶呤,按需口服塞来昔布止痛,以重组人α-葡萄糖苷酶(rhGAA)治疗GSDⅡ,腰痛及四肢乏力均改善,但仍有腰部活动受限,目前随访中。
讨论
GSDⅡ也称为Pompe病,是一种罕见的常染色体隐性遗传病,在汉族人群发病率约为0.002。GSDⅡ是由于编码酸性GAA的基因发生突变,溶酶体内GAA活性缺乏而导致糖原难以降解,从而沉积在骨骼肌、心肌及平滑肌等细胞中,引起溶酶体肿胀、细胞破坏及脏器功能损害,进而出现一系列临床表现。
根据患者的发病年龄、受累器官及疾病进展速度,GSDⅡ分为婴儿型与晚发型两大类。其中,晚发型GSDⅡ于1岁后起病,首发症状通常为体力活动后容易疲劳,并出现下肢较上肢明显的近端肢体肌无力,随病情进展可出现行走、上下楼梯及蹲下后起立困难。
少数患者早期即可出现选择性肌无力,如膈肌、肋间肌及腹肌受累可出现咳嗽无力与呼吸困难,甚至以呼吸衰竭为首发表现。
临床上对于躯干肌、四肢近端肌群及呼吸肌受累为主的肌无力患者,可通过CK升高及肌电图提示肌源性损害进行GSDⅡ筛查。
肌肉活检见肌纤维空泡变性,MGT及PAS染色见肌纤维中见糖原明显增多,并溢出在肌纤维周围,结合外周血淋巴细胞GAA活性下降可进一步提示GSDⅡ的诊断。GAA基因突变分析有助于明确诊断。
本文报道的病例存在对称性近端肌无力、血清肌酶升高及肌电图提示肌源性损害,符合1975年Bohan/Peter建议的PM分类标准,故考虑PM可能。
然而,PM病理检查较少出现肌纤维空泡变性,而本病例肌肉组织炎症渗出不明显,结合对糖皮质激素等免疫抑制剂反应欠佳,诊断PM存疑。
随后回报的病理检查见肌纤维大量糖原沉积,而遗传学检查发现GAA基因c.1634C>T杂合及c.1843G>A杂合均为GSDⅡ常见的基因突变,结合患者接受rhGAA替代治疗后肌无力改善,GSD II诊断明确。GSD II与PM在临床表现及辅助检查等方面非常相似,临床工作中极易混淆。
目前,GSD II与PM的鉴别诊断主要依靠肌肉病理,如进行MGT及PAS染色发现肌纤维空泡变性伴大量糖原沉积,则更倾向于GSD II的诊断。通过检测外周血淋巴细胞GAA活性及GAA基因突变分析有助于GSDlI的诊断。
RSS常见于GSD及进行性肌营养不良等肌肉疾病,临床表现为脊柱活动受限,逐渐出现为脊柱侧弯及限制性通气功能障碍。
LaforOt等报道RSS好发于晚发型GSDⅡ患者,与腰椎前凸、低BMI及呼吸肌受累相关,可伴轻微机械性腰痛。
本病例存在慢性腰痛,需要与青年男性易患的SpA从以下4个方面进行鉴别。
①RSS多以脊柱活动受限为首发症状,疼痛轻微,而SpA则在炎症性腰痛的基础上逐渐出现腰部活动受限,可伴外周关节和(或)肌腱端肿痛。
②sDA可出现葡萄膜炎、银屑病及炎性肠病等关节外表现。
③RSS患者肌酶多有升高并肌肉疾病所对应的遗传学指标异常,而SpA患者ESR及CRP等炎症指标升高,常伴HIA-B27阳性。
④脊柱及骶髂关节影像学检查是RSS及SpA的鉴别要点,而磁共振提示骶髂关节炎对SpA的诊断有重要意义。
因此,虽然本病例为青年男性并出现慢性炎症性腰痛。但GSDⅡ诊断明确、炎症指标正常、HLA—B27阴性结合骶髂关节X线及磁共振检查均无异常,SpA诊断不成立而更倾向于RSS。换言之,炎症性腰痛并非SpA特异性的临床表现,需要结合其他病史及辅助检查进行综合判断。
综上所述,临床上以躯干肌、四肢近端肌群及呼吸肌受累为特征的肌无力患者,应注意排除GSDⅡ。此外,对于炎症性腰痛的患者,应充分考虑其病史及辅助检查结果,注意排除SpA以外的其他疾病。