细胞程序性坏死,也称为坏死性凋亡(necroptosis),是一种受遗传调控的、能够引发细胞溶解性死亡的细胞死亡途径。是多种炎症性疾病和退行性疾病发生发展的重要原因。
细胞程序性坏死通常由凋亡信号通路的某些组分激活,如 TNF-α,通过 RIPK1 和 RIPK3 的激活,最终导致 MLKL 的磷酸化和细胞膜的破裂,从而引发细胞死亡。
以往的研究表明,TNF 激活的 RIPK1 可能进入细胞核并调节与炎症反应相关的基因转录。然而,RIPK1 和细胞程序性坏死在衰老型疾病中的作用和机制仍未被探明,RIPK1 是否在细胞核内介导细胞死亡信号也尚不清楚。
近期,一篇由中国科学院上海有机化学研究所许代超课题组发表于Nature Cell Biology 的研究论文,揭示了由 RIPK1 介导,毒性蛋白 Prelamin A 启动的新型细胞核程序性坏死通路。为治疗由于 Prelamin A 引起的衰老相关疾病提供了新的治疗策略。

▲原文链接:https://doi.org/10.1038/s41556-024-01374-2
Prelamin A 是核纤层蛋白 lamin A 的前体形式,由 LMNA 基因编码。在细胞中,lamin A 的合成起始于 Prelamin A, Prelamin A 包含一个 C 端的法尼基化(farnesylation)修饰,这个修饰使得 Prelamin A 能够与 ZMPSTE24(一种重要的锌金属蛋白酶,在lamin A的成熟过程中发挥关键作用)相互作用并进行内切割,形成成熟的核纤层蛋白 lamin A。
正常情况下,Prelamin A 会被高效地转化为成熟的 lamin A,从而维持细胞核的结构和功能。
然而,当出现 ZMPSTE24 缺陷或其它异常时,prelamin A 的处理和转化可能受到影响,导致其异常积累并引发一系列细胞核异常和疾病表型。
RIPK1在促进ZMPSTE24缺陷细胞的坏死途径中扮演什么角色?
在这项研究中,研究者发现,当 ZMPSTE24 缺失后,细胞对 TNF 刺激下 RIPK1 介导的坏死凋亡变得敏感,且这种敏感性的增加由 RIPK1/RIPK3/MLKL 介导的程序性坏死引起,并依赖于 Prelamin A 。
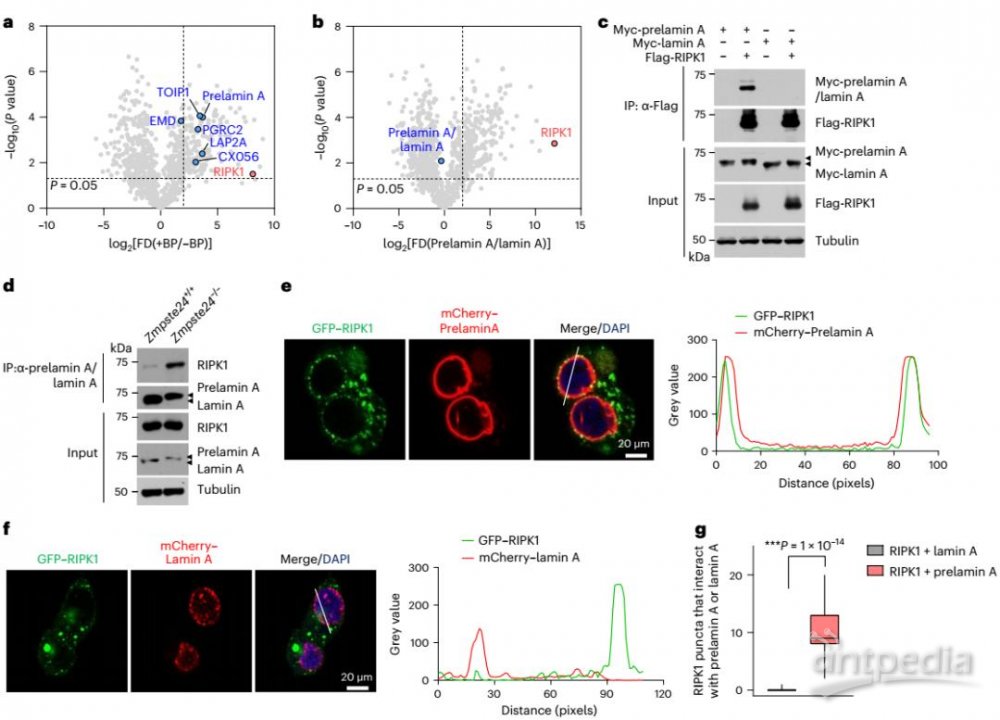
▲Prelamin A与RIPK1相互作用
在 ZMPSTE24 缺失的细胞中,prelamin A 的积累导致其与 RIPK1 结合,并促进 RIPK1 在细胞核内的激活。这种相互作用形成了核坏死小体,进而引发了核内 MLKL 的激活和核膜的破裂,最终导致细胞的程序性坏死。
这种细胞核坏死途径依赖于法尼基化(farnesylation)修饰。法尼基化修饰使得 Prelamin A 能够与核膜结合,形成一个核膜上的支架结构,为坏死信号传导提供了平台。在 ZMPSTE24 缺失的情况下,Prelamin A 的积累导致其无法被正常切割成成熟的 lamin A,从而使得这种支架结构持续存在,促进细胞核内坏死小体的装配。
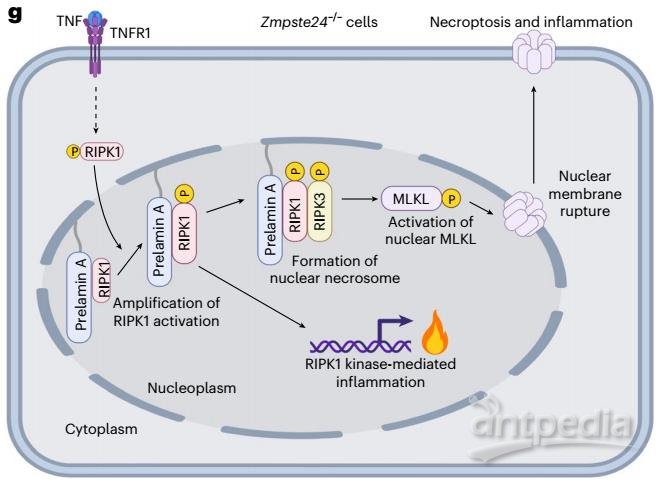
▲Prelamin A启动的由核RIPK1介导的非典型细胞核程序性坏死途径机制
通常,ZMPSTE24 缺失的人类在出生时就会死亡,而在实验中,Zmpste24-/-小鼠在出生时看起来正常,但很快就会发展出老年型表型,包括生长迟缓、脱发、自发性骨折、肌肉无力和过早死亡。
研究者发现 RIPK1 和程序性坏死在 Zmpste24-/-小鼠的多个组织中被激活,而通过抑制 RIPK1或敲除 RIPK3 或 MLKL基因,可以显著抑制细胞程序性坏死的发生,挽救Zmpste24-/-小鼠的疾病表型,并延长它们的寿命。
具体表现为,Zmpste24-/-;Ripk1D138N/D138N、Zmpste24-/-;RIPK3-/-和Zmpste24-/-;MLKL-/-小鼠在皮肤、回肠和肋骨等方面表现出完全恢复,包括皮下脂肪层、毛囊结构和肋骨骨折等老化相关表型得到改善。这表明遗传手段抑制坏死途径对于治疗由 Prelamin A 引起的衰老相关疾病具有潜在的疗效。
小结
综上,这项研究揭示了一种新型细胞核坏死途径,即由于ZMPSTE24缺失导致的prelamin A的异常处理促进了核内RIPK1介导的非传统坏死途径。在这一途径中,prelamin A的积累导致其与RIPK1相互作用,招募RIPK1到细胞核中,并促进其激活。激活的RIPK1进一步与RIPK3相互作用,促进MLKL的激活,导致核膜破裂和细胞核坏死。这一过程依赖于farnesylation修饰,使得prelamin A能够作为坏死信号传导的核内平台。
研究结果表明,通过遗传性抑制坏死途径可以减轻ZMPSTE24缺失引起的病理表型,为治疗与prelamin A相关的病理性疾病提供了新的思路,同时也将RIPK1作为一个潜在的治疗靶点。