
肥胖已成为全球流行病之一,它会增加胰岛素抵抗、2型糖尿病、脂肪肝、心血管疾病和某些癌症等疾病的风险。肥胖是一种慢性疾病,由遗传因素、生活方式、饮食、肠道菌群、能量代谢失衡等多种因素造成。由于摄入的能量比消耗的能量多,导致白色脂肪组织(WAT)以甘油三酯的形式储存过多的能量从而引起肥胖。目前主要的减肥策略是限制能量的摄取和吸收,然而并没有很好的解决肥胖的发病现状。已有研究表明,褐色脂肪组织(BAT)有助于控制体重、促进健康并具有抗肥胖作用。因此,增加BAT活性可能是防治肥胖及其相关疾病的一种新颖有效的治疗方法。
大多数研究表明膳食纤维对能量代谢的有益影响主要集中在肠道微生物群产生的短链脂肪酸(SCFAs),而针对长链脂肪酸(LCFAs,含有14-20个碳的饱和或不饱和脂肪酸)对宿主代谢的影响方面的研究甚少。已有报道中药(如灵芝)可以通过增加益生菌和减少致病菌来调节肠道菌群的组成,从而防止肥胖等疾病的发生和发展。中科院动物所金万洙团队和延边大学全林虎研究团队立足于长白山道地药材--人参,探讨人参提取物(GE)对肠道菌群的潜在调节作用,旨在识别特定的菌株及其代谢产物,特别是介导人参抗肥胖作用的LCFA作用机制,相关研究成果近日发表于Gut期刊。
GE激活BAT提高能量代谢降低肥胖
本研究对肠道菌群和BAT介导的GE抗肥胖作用进行评估。相比对照组,正常db/db小鼠口服GE(10 mg/ kg/d)8周后体重增加明显减少(图1A),全身脂肪百分比下降11%(图1B),附睾脂肪器官重量明显下降(图1C),而BAT、皮下脂肪(Sub)、肝脏器官重量未见明显变化(图1C)。结果表明,GE处理显著降低了db/ db小鼠的体重和肥胖程度。肥胖症常伴随着能量平衡的改变,作者通过间接量热法分析GE处理是否会影响能量代谢。与对照组相比,GE处理显著增加了能量消耗(图1D),而在食物摄取量、能量摄取量、体力活动、呼吸交换比(RER)、未被吸收的能量方面两组则没有显著差异。能量平衡的结果提示GE的抗肥胖作用是由于能量消耗增加,而不是由于食物摄入量减少或体力活动增加发挥作用。
当动物暴露于寒冷环境(4℃, 4h)时,GE处理促使核心体温显著升高(图1E, F)。GE还可改善葡萄糖稳态、胰岛素敏感性、逆转肝脏脂肪变性。这些结果表明GE处理能够改善肥胖小鼠的能量稳态。可部分归因于BAT的产热活性提高(图1G)和解偶联蛋白1(UCP1)的表达增加,通过BAT和Sub中的解偶联过程和OXPHOS表达而产生热量(图1H, I)。BAT是一种生热器官,对维持核心体温至关重要,其生热活性在热中性时受到抑制。然而,GE处理并不影响热中性体重增加。这一结果证明GE的抗肥胖作用依赖于BAT活性。综上所述,GE激活BAT增加全身能量代谢,而不改变能量摄入或体力活动。

GE处理诱导粪肠球菌富集
已有研究表明人参皂苷可以通过肠道菌群的作用而脱糖,由此作者推测肠道菌群是否可以在GE处理的小鼠中发挥抗肥胖作用。作者通过16S rDNA测序分析粪便样本中菌群多样性。GE处理的小鼠菌群α多样性(ACE, Chao 1, Shannon指数和Simpson指数)显著低于对照组小鼠。主成分分析显示两组菌群具有明显差异性(图2A)。但经GE处理后,门水平的比例丰度(尤其是厚壁菌门和拟杆菌门)无显著差异。在db/ db小鼠中,GE显著改变了35个OTU。有趣的是,粪肠球菌在科-属-种水平上显著富集(图2B-D),结果表明GE诱导肠道菌群的组成显著改变,且粪肠球菌显著富集(图2E)。

粪肠球菌能减少肥胖
粪肠球菌是革兰氏阳性细菌,隶属于乳酸杆菌目。粪肠球菌是健康人体胃肠道常见补体,也是医院获得性感染的重要因素。为了研究粪肠球菌在肥胖中的作用,以高脂饮食小鼠为模型,结果发现,粪肠球菌移植小鼠体重显著增加,脂肪显著减少(图3A, B)。粪肠球菌处理是否会影响能量代谢?当动物暴露于寒冷环境时,粪肠球菌处理显著提高了核心体温(图3C, D)。与对照小鼠相比,粪肠球菌处理的小鼠能量消耗显著增加(图3E),组织学结果显示粪肠球菌处理小鼠BAT中脂滴大小显著缩小(图3F),小鼠的BAT和亚脂肪组织中UCP1和OXPHOS蛋白表达显著上调(图3G, H)。这表明粪肠球菌处理可以改善葡萄糖稳态并逆转肝脏脂肪变性。而且,上述有益影响与食物摄入量、体力活动或RER的差异无关,粪肠球菌处理不会影响热中性时体重的增加。总之,粪肠球菌通过激活BAT和米色脂肪形成而增加能量消耗进而降低肥胖。

补充肉豆蔻油酸可降低肥胖
粪肠球菌是否通过肠道微生物发酵过程中产生的代谢产物从而影响宿主能量代谢呢?据报道UCP1可被LCFA激活,LCFA作为永久附着于UCP1的底物,可促进H+从线粒体内膜向外膜转移,那么粪肠球菌移植是否能改变血清LCFAs?本研究对血清LCFAs进行非靶向代谢组学分析,发现粪肠球菌灌胃显著改变多种LCFAs(图4A)。为了鉴定粪肠球菌处理后哪些LCFA发生了特定变化,作者对有和没有粪肠球菌处理的培养基中LCFA含量进行比较,结果发现粪肠球菌处理后肉豆蔻油酸(MA)含量非常高(C14:1),最高达到未处理的12.3倍(图4B)。此外,十九烷酸(C19:0)和亚油酸(C18:2)出现一定程度的显著积累(分别是未经处理组的5.9和4.3倍),但其他LCFAs变化较少 (图4B),提示粪肠球菌可能参与脂肪酸代谢。
进一步研究LCFAs对BAT活性的潜在影响,对初生棕色脂肪细胞进行了各种LCFAs处理,并对细胞耗氧量进行评估,结果表明MA显著上调耗氧量(图4C),增加了UCP1的表达,提示MA可能增加了BAT活性。荧光素酶活性显示,内源性UCP1表达的转基因小鼠经MA处理后,荧光素酶活性显著增加,提示MA对肥胖具有潜在疗效。为了验证上述假设,db/db小鼠灌胃MA,MA通过增加BAT产热和全身能量代谢显著改善了小鼠体重的增加(图4D)和肥胖(图4E-G),同时发现MA激活BAT(图4H,I)诱导米色脂肪形成(图4J),逆转肝脏脂肪变性。这些有益的影响与食物摄入量、体力活动或RER并无显著的相关性。
由于UCP1 敲除小鼠的BAT活性降低,作者使用UCP1 敲除小鼠来进一步验证MA对BAT的抗肥胖作用。结果发现,在野生型(WT)小鼠中,MA能够改善HFD诱导的体重增加,但UCP1敲除小鼠中,MA处理未见改善。在野生型(WT)小鼠中,MA可以增加BAT的产热和改善HFD条件下的葡萄糖稳态(由于体温过低,未在UCP1敲除小鼠上进行这一实验)。同时,WT小鼠能量消耗呈现增加趋势,而UCP1 敲除小鼠的能量消耗未见增加;在野生型(WT)小鼠中,MA可以改善BAT肥大,逆转肝脏脂肪变性,但UCP1敲除小鼠中,MA处理未见改善。WT小鼠经MA处理后,UCP1蛋白表达显著上调。这些有益的影响并不是通过食物摄入或身体活动来调节的。MA处理并不会影响热中性时体重的增加。综上,粪肠球菌产生的MA通过增加BAT活性和全身代谢来减少肥胖。
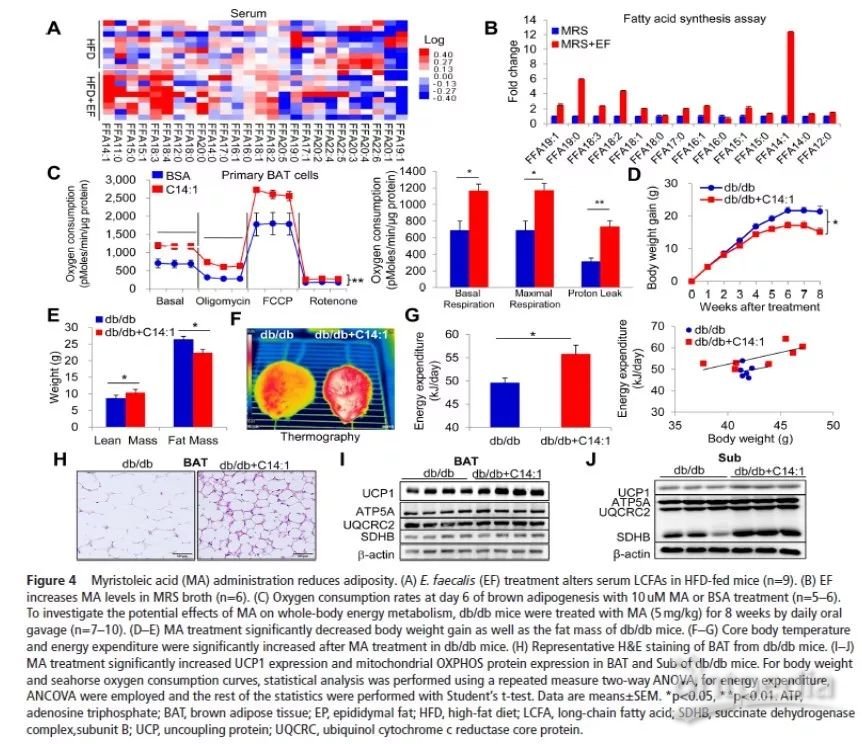
减少粪肠球菌产生MA可削弱抗肥胖作用
已有研究表明Acyl-CoA硫酯酶(ACOTs)能催化羰基和硫原子之间的硫酯键水解产生脂肪酸和CoA(图5A)。为了阐明粪肠球菌如何参与MA产生,作者利用Crispr-dCas9技术构建ACOT基因敲除(KD)和WT粪肠球菌株(图5B),并在De Man, Rogosa+Sharpe (MRS)培养基中培养WT和KD E. faecalis菌株,对LCFAs进行非靶向代谢组学分析。发现WT菌株始终能够诱导MA的积累,而ACOT KD菌株诱导的MA积累量少于WT菌株(图5C)。与WT E. faecalis菌株相比,ACOT KD E. faecalis对其他LCFAs或SCFAs的影响不显著。表明MA的产生部分由ACOT介导。
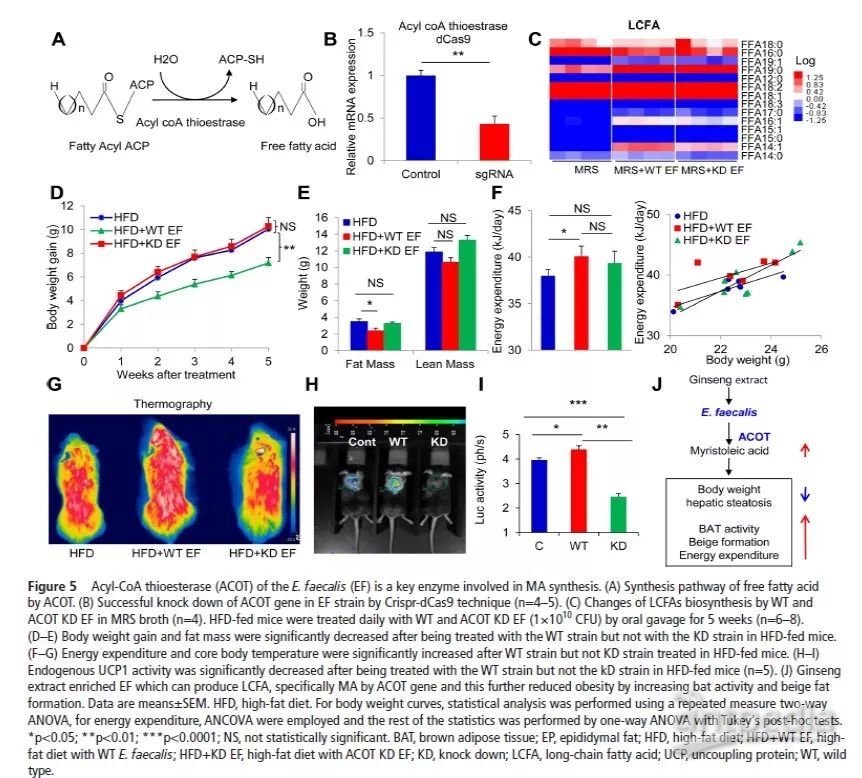
为了研究转基因的粪肠球菌菌株对UCP1活性的影响,作者采用多种小鼠模型进行验证。研究发现WT粪肠球菌可以减少HFD小鼠的肥胖(图5D,E),也能够增加冷诱导的生热作用(图5G)和能量消耗(图5F),而KD粪肠球菌则不能,食物摄入量亦无显著变化。在UCP1荧光素酶转基因小鼠模型中,WT菌株中的内源UCP1活性显著上调,但粪便中的KD粪肠球菌处理则未见显著上调(图5H-I)。为了避免肠道菌群之间的种间串扰,对小鼠进行ABX预处理,发现WT可增加BAT活性和冷诱导的生热作用,而KD株处理的db/db小鼠则不能。这些结果清楚地说明ACOT基因在MA生物合成中的重要作用,粪肠球菌通过ACOT基因促进MA的产生。
小结
本研究通过肠道微生物组和血清代谢组,发现GE处理后粪肠球菌在科-属-种水平上显著富集,粪肠球菌富集可诱导生成肉豆蔻油酸(MA),从而发挥抗肥胖作用。同时揭示了粪肠球菌通过ACOT基因促进MA的产生,敲除ACOT基因大大降低了MA的产生,从而阐明GE - E. faecalis - LCFA(尤其是MA)轴通过增加BAT活性和米色脂肪的形成发挥显著的抗肥胖作用。BAT作为一种耗能器官受到广泛关注,增加BAT数量和活动来增加能量消耗或将成为治疗肥胖和代谢性疾病的有效策略。粪肠球菌处理后SCFAs表现出极小的差异甚至于没有差异,而LCFA (MA)的产量明显提高,提示粪肠球菌是一种新型的抗肥胖益生菌,MA是粪肠球菌中新发现的代谢产物,在治疗诸如肥胖等代谢综合征疾病方面具有巨大的潜力。
参考文献
LinHu Quan, Wanzhu Jin, et al. Myristoleic acid produced by enterococci reduces obesity through brown adipose tissue activation. Gut 2019; 0:1-9. DOI: 10.1136/gutjnl-2019-319114.