在神经科学的研究方法中,为了使各种处理手段(给药、毁损、病毒注射等)或信号采集(微电极、探针)到达目的脑区的相应位置,需要使用脑立体定位技术。下面详细介绍确定脑立体定位位点坐标的方法,以及脑立体定位实验过程中的注意事项。
许多老师在确定目标核团的坐标时,往往是参考文献上已有的坐标,然而却发现仅根据文献上的坐标去定位核团往往达不到理想的定位效果,这边我们建议各位老师首先参考脑定位图谱,了解目标核团的大小和形状,这样在进行病毒注射的时候,才能做到有的放矢。具体方法如下。
1首先找到一本合适的脑立体定位图谱:
根据研究目的和小鼠种类不同,分别选择对应的Paxinos & Watson脑立体定位图谱(
大鼠脑立体定位图谱-中文版
大鼠脑立体定位图谱-英文版
小鼠脑立体定位图谱-英文版
发育期小鼠脑立体定位图谱-英文版
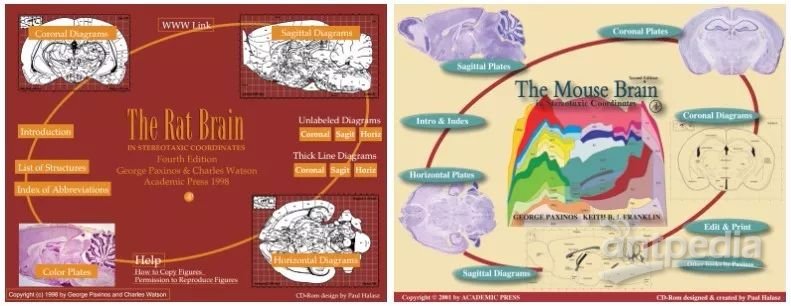
图1.脑立体定位图谱
2查找目标核团的坐标:
a. 如何在图谱中找到目标核团?在选择了合适的图谱后,如果知道目标核团的英文全称,就先在List of Structures中查找缩写,再按照缩写名在Index of Abbreviations中定位到目标核团所在的页码(一个核团可占据多个页码)。
b. 脑立体定位图谱的两个重要平面是什么?首先我们需要明确,大鼠在使用脑立体定位图谱时,需要满足颅骨水平位,而使用颅骨水平位的原因是,脑立体定位的中线旁开坐标以及深度坐标就是根据颅骨水平位来确定的(也就是前囟-人字点、人字点-对耳线两个平面来确定的,如图2)。因此在固定大鼠的时候,需要调整定位仪的门齿杆位置低于水平线3.3±0.4,即达到颅骨水平位。
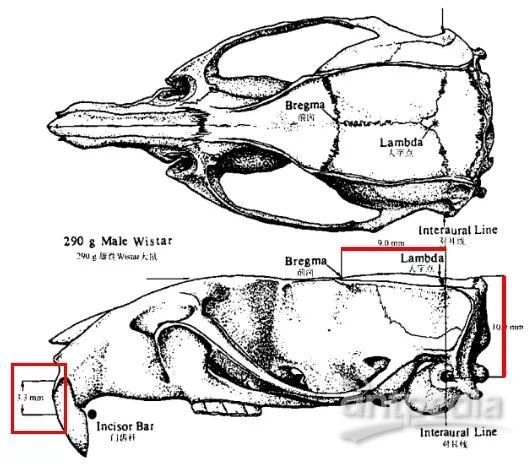
图2.大鼠脑立体定位前囟-人字点、人字点-对耳线平面、门齿杆位置示意图
(红线表示两个平面,红框表示门齿杆的位置)
c. 如何确定目的核团坐标?在翻到该核团所在的页面,多是冠状切面,核团的长度要看所占的页数(右下角有一个Bregma值,用第一页的这个数值减去最后一页的这个数值就是核团的长度)。根据这些数据估算核团的长度。核团的宽度、高度可直接由图上的坐标读出,即在各页面上挑选一个横截面最大的,在核团中心点一点,经这个点划水平线和垂直线,水平线和纵坐标的交点就是核团的深度坐标(颅骨下多少mm),垂直线和横坐标的交点就是核团左右坐标(中线旁开多少mm),右下角的Bregma值就是核团的前后坐标(正值代表前囟前,负值代表前囟后,前囟是骨缝冠状缝和矢状缝的交点)。
3脑立体定位及病毒注射
3.1 实验注意事项:
a. 首先根据以上的注意事项找准脑立体定位点。
b. 荧光、有色染料预实验:在病毒注射之前,为了确定核团定位是否正确,推荐神经顺行示踪的DiI染料于注射后1周,神经逆行示踪的荧光金(Flouro gold)染料于注射后2周切片,并对照图谱确认注射的核团位点无误,再进行病毒注射,可有效提高病毒标记的成功率。冰冻切片时注意,先从所要核团外开始切(还不到核团所在层面),拿到的切片对照图谱中的一些参照物来判断核团是否准确(对照物可选大而清晰的海马、视交叉,脑室、核团附近的特殊结构如纤维索等等),切片同时注意调节冻台角度,使切片角度与图谱一致。
c.注意小鼠的状态:由于俯卧体位以及脑立体定位仪的夹持,容易造成小鼠窒息死亡,因此需要随时确认小鼠气道通畅。另外,对于手术切开的部位,应适当滴加生理盐水,防止伤口干燥。
d. 大鼠颅骨水平位定位操作:定位时将大鼠固定成颅骨水平位后,先定位到前囟,以前囟为原点,向前或向后、向左或向右、向下(先在颅骨上打孔)到达核团位置,需要强调的是,坐标是以前囟为原点,而不是以钻孔后的脑表面为原点。
e. 熟能生巧:通过多加练习,最后能根据所用动物的体重对坐标做相应的修正,保证一定得准确率,立体定位也就成功了。
3.2 小鼠固定及病毒注射实验:
a. 将麻醉剔毛后的小鼠固定到立体定位仪上。
b. 固定时,先将小鼠门齿卡在适配器门齿夹上,轻轻压上门齿夹横杆,调整适配器高度和前后,使耳杆可以方便进入小鼠外耳道,且调整定位仪的门齿杆位置低于水平线3.3±0.4,即达到颅骨水平位。
c. 左手托起小鼠头部,将左侧耳杆插入小鼠耳道,调节左右侧耳杆使动物头部保持在U型开口的中心位置,先锁紧固定一侧耳杆,后旋紧另一侧耳杆,使动物头部不能晃动,同时旋紧门齿夹螺丝。
d. 检查是否固定成功:鼻对正中,头部不动,提尾不掉,目测大脑放置水平。
e. 用脱毛膏或者剃刀将需要手术部位的毛发去除。
f. 然后用手术刀划开小鼠头部皮肤,去除颅骨表面结缔组织,暴露前后囟(图3)。
图3. 大鼠固定并划开头部皮肤示意图
g. 根据确定的注射脑区的位置参数,以前囟Bregma为0点,移动颅骨钻,用笔标记处核团的位置范围,再根据该范围的大小打开合适的骨窗(窗口尽量小但是又不妨碍实验)。小心地用颅骨钻在注射位点处轻磨颅骨,将颅骨慢慢打薄,当颅骨出现裂缝的时候,用医用注射器的针头小心挑破,防止损伤,如果在此过程中有出血,可以用很小的医药棉球拉成长条形将血吸走,钻孔时一定要控制好,否则很容易在钻通颅骨后一不小心钻头进入脑组织,造成损伤。
h. 用PBS冲洗微量注射器(5μl规格)3-5次,洗干净后在空气中测试注射器是否通畅。然后先吸取1μl空气,再吸取1μl稀释好的病毒(方便病毒充分注射进脑)。将微量注射泵,微量注射器组装好,并置于钻好的孔上方,针尖与颅骨平行(Z=0),微调注射器位置与之前钻孔时位置相同,根据定好的深度将注射针缓慢下降。一般设置微量注射器在10分钟内注射将病毒注射完毕,再保留8-10分钟,一方面让病毒扩散,一方面防止病毒随着针拔出而漏出核团(图4)。
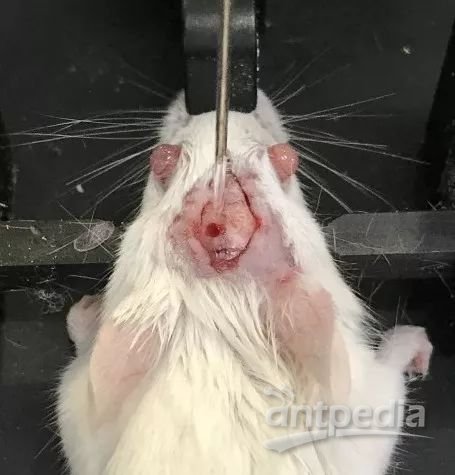
图4. 大鼠病毒注射示意图
i. 注射病毒后,根据之前的实验经验或者文献中建议的时间,作为取材的参考时间,神经系统一般是病毒注射后4-5周取材、切片、观察病毒的表达(图4)。如果是一些长距离投射的神经元(以皮层神经元为例),那么在皮层和相应的脊髓水平都可以看到病毒标记。
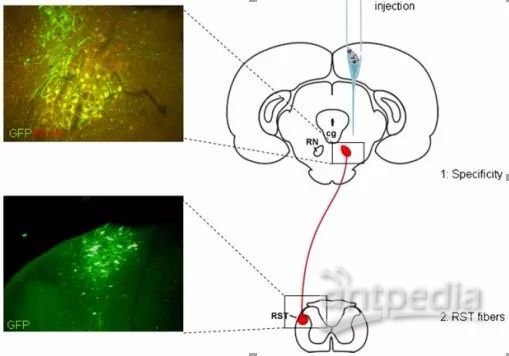
图5. 长距离投射的神经元(以皮层神经元为例)
4如果脑立体定位注射核团有难度怎么办?
有一些核团很小,或者深度很深,或者想要研究神经发育,往往都是胚胎小鼠,无法进行脑立体定位注射,这样的难注射核团怎么办?我们可以使用跨血脑屏障型AAV病毒,只要一针注射到小鼠的腹腔或者尾静脉,AAV病毒就可以自己跨越血脑屏障,并点亮整个脑区,规避掉脑立体定位注射的难题。
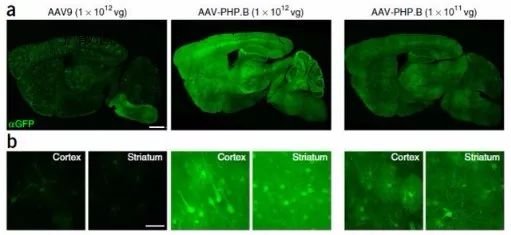
图6. 跨血脑屏障PhP-eB血清型AAV
吉凯基因现推出神经系统专用AAV彩虹试用装,仅需1400元,5个工作日,您就可以试用包括1、Retro、9等神经示踪AAV病毒,为您的神经科学研究助力。
另外,吉凯基因为您提供口碑好、高质量的AAV工具产品,血清型包括1、2、5、7、8、9、DJ、DJ/8、PHP.eB-301、PHP.B-301、PHP.S-301、Retro等常规、跨血脑屏障以及逆行标记类型,研究领域涉及心、肝、肺、胰、肌肉、神经、眼科学等各个领域。同时,我们于2015年在国内率先建立了cGMP级病毒生产车间,可提供临床级别的基因治疗载体病毒,旨在为基因治疗贡献一份力量!详情戳图↓

详情请咨询当地销售工程师。