
嵌合抗原受体T细胞疗法(CAR T细胞疗法)在复发难治性血液瘤治疗中取得了变革性的胜利,但是不同于CAR T细胞疗法在血液瘤中的有效性,CAR T细胞在实体瘤中受到很多阻碍,其中包括CAR T细胞的肿瘤浸润,肿瘤微环境(TME)的免疫抑制以及CAR T细胞体内扩增和持久性差。因此为了提高CAR T细胞疗法在实体瘤中的有效性,Armored CAR T在二代/三代CAR的基础上增加细胞因子分泌,合成受体信号转导和分泌抗体样蛋白来提高CAR T细胞的抗肿瘤能力。
白细胞介素 2 (IL-2) 是效应 T 细胞扩增、存活和发挥功能所需的细胞因子,尤其在T 细胞过继细胞免疫疗法中的应用,但其多效性导致同时刺激和抑制免疫反应,导致全身毒性 ,限制了其在治疗上的应用。因此斯坦福大学Christopher Garcia团队早在2018年Science上发表研究表明人工突变设计的正交IL-2 / IL-2Rβ (oIL-2 / oIL-2Rβ) 可以传递天然IL-2信号,但是不与其对应的天然细胞因子和受体相互作用[1]。
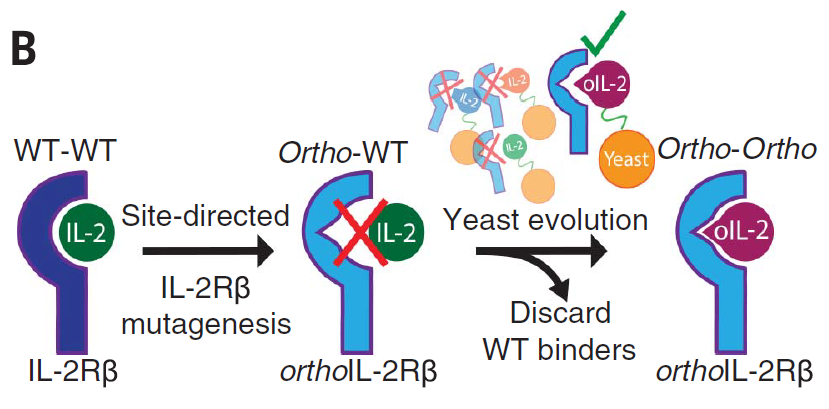
图1. 正交 IL-2/IL-2Rβ对的设计策略示意图
近日,Christopher Garcia团队与CAR T之父Carl June团队以及加州大学 Antoni Ribas等团队合作,在《Nature》上发表了题为:“Potentiating adoptive cell therapy using synthetic IL-9 receptors”的文章。该研究在Science研究的基础上,做了新的尝试,设计了新的嵌合受体, 将正交IL-2R(o2R)的胞内域( ICD)替换为 γc 细胞因子 IL-4、IL-7、IL-9 和 IL-21 的受体 ICD。结果表明,在这些γc 细胞因子中,人工合成的嵌合正交 IL-9 受体(o9R)使过继性 T 细胞在对抗肿瘤时更加具有潜力。

图2. CAR和o2R或o9R结构示意图
进一步研究表明通过o9R信号传导同WT IL-9R一致,都将导致下游STAT1、STAT3和 STAT5磷酸化,并在黑色素瘤和胰腺癌小鼠实体瘤模型中产生了很好的的抗肿瘤效果,即使在没有放化疗情况下,黑色素瘤小鼠治愈率达60%!

图3. o9R-pmel T细胞在B16-F10黑色素瘤小鼠体内展现超强的抗肿瘤作用
在体外评估模型研究中,研究人员使用xCELLigence RTCA实时阻抗技术在小鼠和人源细胞模型中来评估CAR-o9R T细胞长期和连续的杀伤效率。图4. c 图中小鼠CAR-o9R T 细胞在25h 就将MSLN阳性的胰腺导管腺癌细胞系PDA7940完全清除,而小鼠CAR-o2R T 细胞在40h才能做到100%杀伤。
xCELLigence RTCA在长期连续的抗原暴露实验中也展现稳定的优势,图4. h 中人CAR-ho9R T 细胞在人转移性胰腺癌细胞AsPC-1持续的4次rechanllenge后仍保持强力的肿瘤杀伤能力,并伴随T记忆干细胞(TSCM)比例的增高。
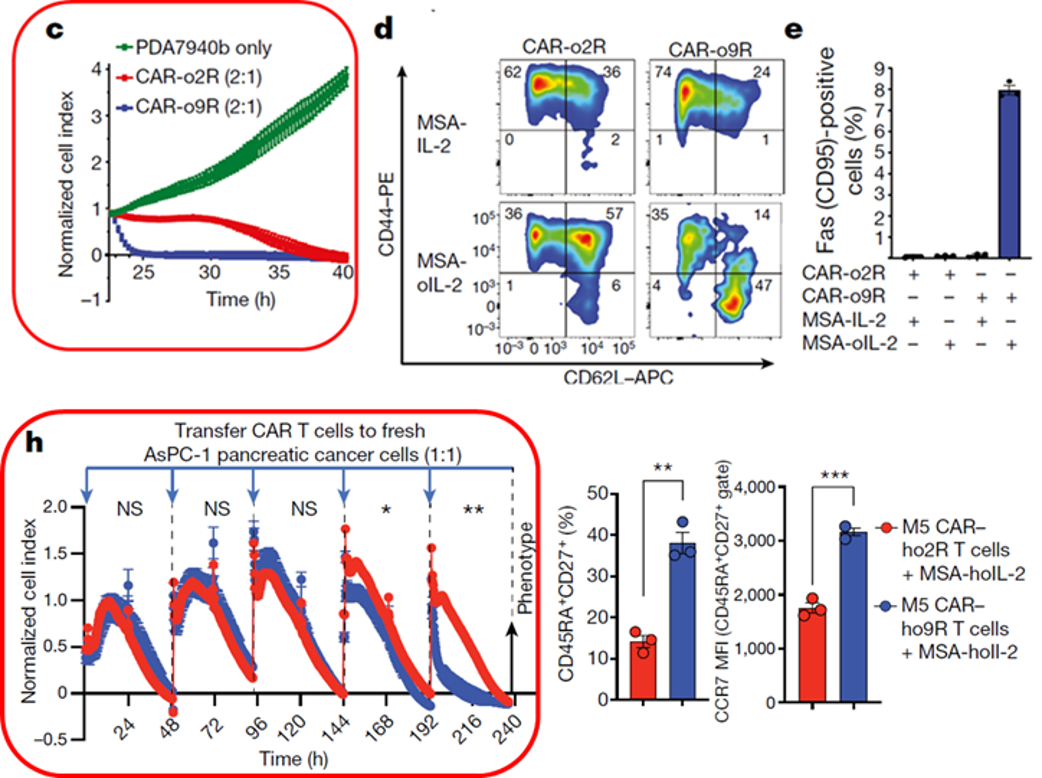
图4. o9R信号提高 CAR T 细胞体外杀伤能力并增加TSCM细胞比例
小结:该研究通过将o2R的ICD替换为 γc 细胞因子后,对下游激活信号的研究锁定IL-9R的嵌合受体o9R。在两种难治型癌症模型(胰腺癌和黑色素瘤)中,通过TCR T和CAR T细胞来攻击肿瘤细胞。从体内和体外数据来看,o9R T细胞在胞内传递IL-9Rα信号诱导T细胞形成趋向于TSCM和Effector T细胞表型,因此增强了T细胞的抗肿瘤能力。该研究推动了实体瘤研究的前进,为人类攻克实体瘤提供了新的思路。
有关armored CAR T 的另一研究
Carl June 团队参与的实体瘤armored CAR T的另一研究于今年1月份发表在《Natutre Medicine》,题为:“PSMA-targetingTGFβ-insensitive armored CAR-T cells in metastaticcastration-resistant prostate cancer: a phase 1 trial”。

CAR T细胞疗法在应对实体瘤时最大的挑战是肿瘤微环境的免疫抑制,其中转化生长因子β(TGF-β)是促进免疫抑制的一个关键的细胞因子,由肿瘤细胞分泌,可以损坏T细胞功能的同时促进免疫抑制性调节性T细胞(Treg)的发育 [2] 。因此在T细胞上抑制TGF-β信号可以有效促进效应T细胞的抗肿瘤活动。
该研究披露了靶向前列腺特异性膜抗原(PSMA)伴有dominant negective TGF-β receptor(TGFβRDN) armored的CAR T细胞治疗雄激素阻断疗法抗性前列腺癌(mCRPC)的一期临床数据(NCT03089203),表明抗TGF-β的CAR T细胞疗法治疗实体瘤是安全可行的。
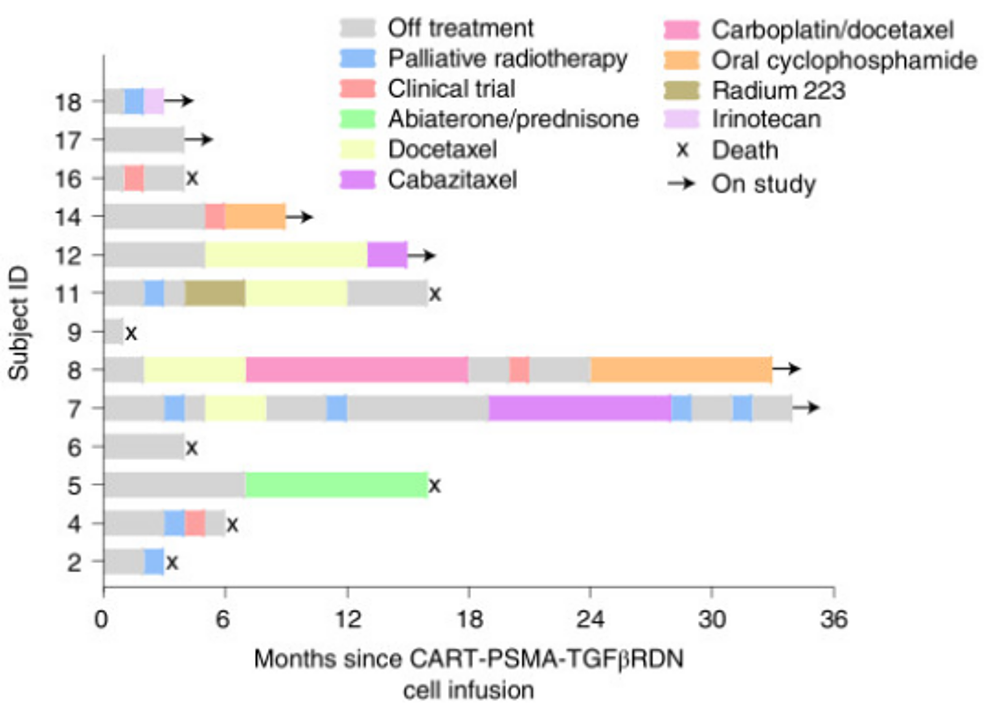
图5. 受试者的研究时间、后续治疗和现状的泳池分布图
在NCT03089203试验中,主要终点是安全性和可行性,次要目标包括评估 CAR T 细胞分布、生物活性和疾病反应。18名mCRPC患者(IHC PSMA≥10%)预筛纳入这项试验,其中13人接受了4种不同剂量的细胞回输。13人中有5人出现2级或以上细胞因子释放综合征,但均通过药物获得改善。13人中有4人(30.1%)的血清前列腺特异性抗原(PSA)下降≥30%,有5人(38.5%)在3个月的影像学评估中维持SD。总体而言,这13例受试者的中位OS为15.9个月,中位PFS为4.4个月。可以说,该项临床研究提供了对靶向PSMA TGFβRDN armored CAR T疗法安全性的深入了解,证实了该armored CAR T的安全性和可行性。
有其他研究表明TGFβRDN而不是TGFβRKO可以导致T细胞的异常增殖和转化。在支持这项临床研究的体外实验中,研究者对比了CART-PSMA-TGFβRDN和CART-PSMA-TGFβRKO在体外的信号转导,增殖和杀伤。其中xCELLigence RTCA实时阻抗技术在PC3-PSMA细胞模型中来评估CART-PSMA-TGFβRDN和CART-PSMA-TGFβRKO细胞长期和连续的杀伤效率,结果表明TGFβRDN和TGFβRKO都没有影响PSMA CAR T细胞的杀伤能力。

图6. TGFβRDN和TGFβRKO体外对PSMA CAR T 细胞的增殖和杀伤都无明显影响
小结:研究人员开展了PSMA TGFβRDN armored CAR T细胞的一期临床试验,在13个mCRPC病人中验证了该产品的安全性和可行性。该结果也证实了从改善肿瘤免疫抑制微环境为出发点设计新一代CAR 有很大的治疗前景,为未来进一步提高实体瘤疗效奠定了基础。
在细胞免疫治疗药物研发过程中,体外肿瘤细胞杀伤试验是应用最广泛的筛选手段,传统杀伤实验主要应用Luciferase系统,需要将luciferase转导进靶细胞进行表达,所以该实验在原代细胞以及转导效率低的靶细胞上很难应用。而且该方法只能做到终点分析,对于长期检测实验操作起来繁琐费力,容易造成数据的不稳定。
安捷伦xCELLigence® 实时细胞分析仪 (RTCA) 无需对细胞做任何标记就可以实时分析细胞的生长,全程自动检测。同时我们的xCELLigence RTCA eSight将显微成像与实时电阻抗检测进行结合,在一台仪器中实现了活细胞成像与高灵敏度实时无标记技术两种方法学的同步检测与分析。在CAR T杀伤实验中,可持续追踪靶细胞被杀伤的进程,同时,其具有的明场和三色荧光(红,绿,蓝)配置可对细胞实时成像,提供杀伤研究的正交读数。
参考文献
Selective targeting of engineered T cells using orthogonal IL-2 cytokine-receptor complexes Science 359, 1037–1042 (2018)
Regulatory T cells promote cancer immune-escape through integrin αvβ8-mediated TGF-β activation Nature Communication| (2021) 12:6228
关于安捷伦
安捷伦科技有限公司(纽约证交所:A)是生命科学、诊断和应用化学市场领域的全球领导者,致力于为提高生活质量提供敏锐洞察和创新经验。安捷伦的仪器、软件、服务、解决方案和专家能够为客户最具挑战性的难题提供更可靠的答案。2021财年,安捷伦营业收入为63.2亿美元,全球员工数约为17,000人。