
生物药物包括单抗、重组蛋白、病毒载体等,通常都是通过细胞表达产生,经过纯化、除菌过滤、制剂工艺后获得。在工艺过程中会产生包括微生物污染、热原、细胞成份、培养基中的成份等外来杂质,这些杂质会影响最终药品的安全性和有效性,在开发过程中对杂质的鉴别、定量、定性和控制是非常重要的。

1)内毒素
内毒素是革兰氏阴性细菌细胞壁中的一种成份,叫做脂多糖,由细菌死亡自溶时释出,又称之为“热原”,进入人体内会引起急性炎症反应。
目前对于内毒素的检测主要分为:基于传统的鲎采血的 LAL/TAL 法,和出于对鲎资源的保护而新起的基于重组 C 因子的内毒素检测方法。LAL/TAL 法是从栖生于海洋的节肢动物“鲎”的蓝色血液中提取变形细胞溶解物制作而成,LAL 试剂来自于美洲鲎,TAL 试剂来自于东方鲎。LAL/TAL 法一般通过多个酶促级联凝固,以凝胶法、比浊法或显色法定量。LAL/TAL法简单、快速、灵敏、准确,因而被欧美药典及我国药典定为法定内毒素检查法,并已被世界各国所采用。
重组 C 因子法是利用重组技术合成的内毒素特异性酶,被活化后可直接与荧光底物作用产生与内毒素浓度成比例的荧光信号,从而实现定量。由于内毒素检测的需求持续上升,而鲎资源却在急剧紧缩,因此重组 C 因子法目前已被世界主流药典认同。
丹纳赫生命科学旗下美谷分子的多功能酶标仪可用于 LAL 法和重组 C 因子法的多种内毒素试剂盒检测。

SpectraMax i3x 上的
动态显色LAL 实验
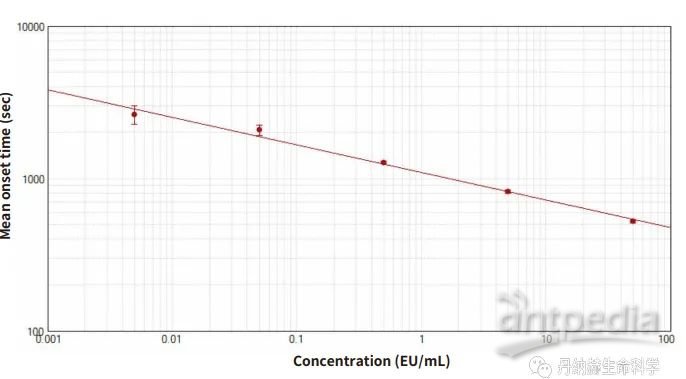
SpectraMax M5e 上的
动态显色 LAL 实验

MD的SpectraMax i3x
多功能酶标仪

MD的SpectraMax M5e
多功能酶标仪

采用 PyroGene 重组因子 C 试剂盒进行内毒素检测
特别是 SpectraMax i3x 多功能酶标仪具有光吸收、荧光、化学发光和 FRET 检测功能,兼容客户端模块化升级功能,可以根据需要,任何时间随意升级至荧光偏振 FP、HTRF、AlphaScreen、Western Blot、细胞成像和带有注射器模式下的快速动力学检测等,还可进行ELISA宿主细胞残留蛋白、牛源污染物(如:BSA、IgG、胰岛素、铁传递蛋白)、蛋白 A 和 G 等杂质的检测。
2)宿主细胞残留 DNA
宿主细胞残留 DNA(HCD)是一种可能存在于终产品中的工艺相关杂质,存在制瘤性和感染性的风险。现有研究表明,可能引发致病的功能基因至少在 200 bp 以上,因此残留 DNA 片段越大,风险等级越高。美国食品药品监督管理局(FDA)关于人类基因治疗新产品生产指导文件中明确指出HCD的片段要小于 200 bp;国家药品监督管理局(NMPA)生物制品药学部同样在《基因治疗产品药学研究与评价技术指导原则》的征求意见稿中指出,HCD 的片段要小于 200 bp。因此基因治疗终产品中需要合适的方法检测 HCD 的片段大小分布情况。
SCIEX 的毛细管电泳 PA 800 Plus 制药分析系统采用凝胶电泳激光诱导荧光的检测方式,可对宿主细胞残留 DNA 的片段进行高灵敏的检测。使用 SCIEX eCAP™ dsDNA 1000 试剂盒可分离 50-1000 bp 范围的DNA片段,定量限低至 10 pg/mL。若在前处理的过程中对 DNA 进行浓缩处理,可获得更高的检测灵敏度,满足各种残留 DNA 片段分布检测的需求。


SCIEX 的 PA 800 Plus 对慢病毒载体中的 HCD 进行检测
3)不溶性微粒
注射剂药物在生产、运输或使用过程中,因为各种原因造成空气颗粒污染及玻璃瓶掉渣,甚至因为稳定性差导致药物颗粒发生团聚析出。有大量的研究报道,不溶性微粒注射到人体后会产生各种危害,包括:血管栓塞、静脉炎、免疫原性反应等,为此各国药典都对注射液中不溶性微粒的检测做了严格的规定,包括美国 USP788 和 USP787,中国 CP0903,欧洲 EP 2.9.19,以及日本 JP 和韩国 KP ,都对其中10µm 和 25µm 以上的颗粒数做了严格的限制。
需要特别指出的是,眼科溶液的不溶性微粒检查在 USP789 中更加严格,不仅对大于 10µm 和 25µm 的颗粒数有更低限制的规定,而且还对大于 50µm 的颗粒数有要求。
目前中国药典推荐采用光阻法及显微计数法对不溶性微粒进行检测。贝克曼库尔特 HIAC 9703+ 不溶性微粒检测仪,采用光阻法原理,满足多国药典对各类注射剂药物的测试要求,同时根据 USP787 和 CP0903 小体积测试规定,对于珍贵样品单次检测体积只需 200μL ,即单个样品体积不到 1.5mL 即可完成不溶性微粒的检测,在大大节省测试样本的同时保证了制剂的高质量品质。


贝克曼库尔特 HIAC 9703+ 不溶性微粒检测仪
随着制剂技术的快速发展,产生了很多新型制剂,如注射用乳剂、混悬剂等,这类样品的特殊性,不适合用光阻法进行不溶性微粒检测,可采用显微计数法进行检测。徕卡显微系统的DM4P 偏光显微镜使用透射正交偏光进行不溶性颗粒观察,药物颗粒呈亮白色,载玻片呈黑色,色差明显,可以消除分析过程中载玻片颜色对微粒识别的干扰。配合专业的清洁度检测解决方案:scanning stage + LAS X navigator 可以快速自动检测出一定尺寸范围内的颗粒的数量。

徕卡 DM4P 偏光显微镜
生物药物工艺流程的复杂性导致了工艺过程杂质的多样性,不同分析方法的应用推动了工艺流程的优化和药物使用的安全,同时临床上药物的不良反应,又对引起这些不良反应的相关杂质的深入研究起到了推动作用。丹纳赫生命科学的多方位杂质检测方案可以更加深入助力生物药物工艺过程的改善。

更多产品信息咨询,
请点击“阅读原文”,与我们联系。

每周五下午 5 点与您相见
好玩的、划算的、有用的、前沿的
帮助您获取生命科学研究及药物研发全方位的解决方案
产品覆盖微孔板检测分析、高通量筛选、
高内涵成像、高效克隆筛选等。

我知道你在看哟
