

★

→ 文末报名
SPTFF单向流超滤在mRNA平台应用
私享会
mRNA药物市场演变及发展方向
2021年波士顿咨询公司【1】预计到2035年,mRNA市场规模会攀升到230亿美元,新冠疫苗的比例下降到22%,治疗性疫苗比例会达到32%,其他感染性疾病mRNA疫苗比例占到30%,治疗性mRNA药物比例约为16%。分析显示,2035年mRNA疫苗市场中肿瘤治疗性疫苗预计将占mRNA产品销售额的30%,治疗性药物的贡献接近20%。
当前mRNA药物处于持续高速发展阶段,主要可分为如下三个方向:
药物作用机制研究:mRNA具有强大的功能,可以编码不同抗体类型,针对不同靶标开发(肿瘤、传染病、罕见病等),并且可以与技术与细胞/基因治疗平台融合,具有非常广阔的前景。
新型mRNA分子结构:例如自复制mRNA与环状RNA(circleRNA)可以有效改善mRNA的应用剂量/治疗周期/药物稳定性等,是目前的一个热点方向。
不同给药方式及递送平台:皮下注射/喷剂等均在研究之列。已获批使用的mRNA疫苗均使用了脂质纳米颗粒(LNP)药物递送技术,如何突破专利屏障是众多开发者关注要点之一;此外,通过调整LNP的分子结构赋予其靶向肝部以外(如肺部)组织【2】 ,也是目前值得研究的一个新方向。
尽管存在复杂的专利环境,但到目前为止已上市的mRNA疫苗均采用了脂质纳米颗粒类型的递送系统。LNP类型递送系统主要由可电离阳离子脂质、胆固醇、中性辅助磷脂和聚乙二醇修饰的磷脂组成,行业内已经出现多种细分类型,主要体现在系统成份变化及结构变化方面。
mRNA的制备工艺
到目前为止,业界进行mRNA制备的主要工艺路线如图所示,主要包括:质粒制备与线性化 ->体外转录->加帽加性-> mRNA纯化->mRNA-LNP制备->LNP纯化->LNP除菌过滤->制剂灌装。本文主要讨论后段工艺,即mRNA-LNP制备、纯化及除菌过滤过程中需要考虑的工艺要素。
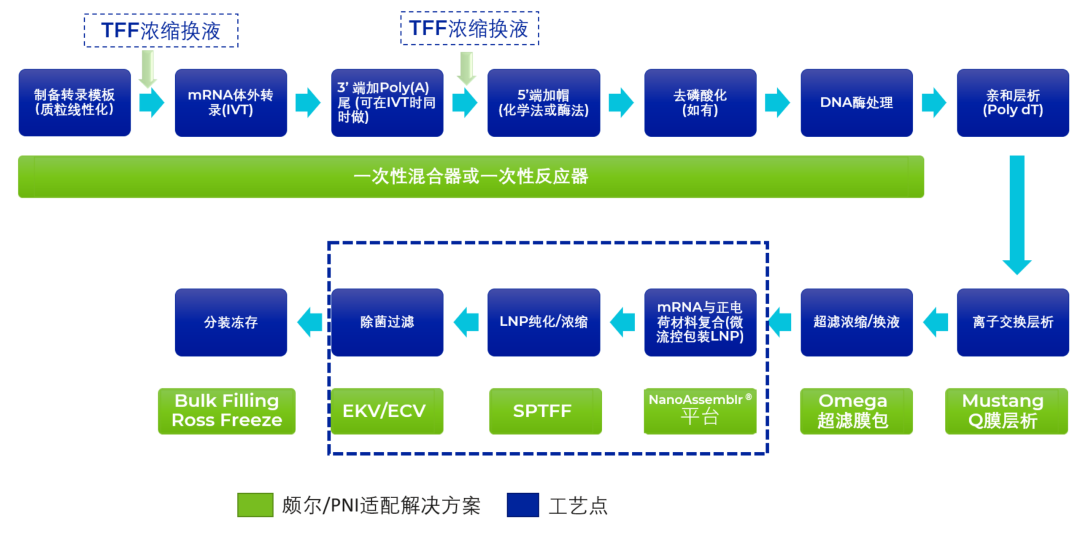
图 mRNA GMP生产流程示意图
mRNA-LNP的制备
目前mRNA-LNP的制备都是通过微流控系统来完成的,微流控过程工艺参数需要考虑总流速、压力、流速比例、芯片内部结构、温度等条件。将核酸与脂质分别溶解在水相和有机相后,纳米药物制备系统推动两相溶液通过特制芯片通道,完成纳米颗粒的合成。参考脂质体的制备过程【2】对脂质体粒径及分散度的影响,结合LNP结构具有更好的自组装性能这一特点,可以预期采用层流方式进行LNP制备可以得到更高质量的LNP。丹纳赫旗下PNI(Precision NanoSystems Inc.)的纳米药物制备系统采用层流控制技术,可以在不同规格下快速完成LNP制备,粒径及颗粒分散度(PDI)均可实现良好控制,PNI拥有一系列不同规格的微流控系统,可以满足用户从研发到GMP生产的各类需求。
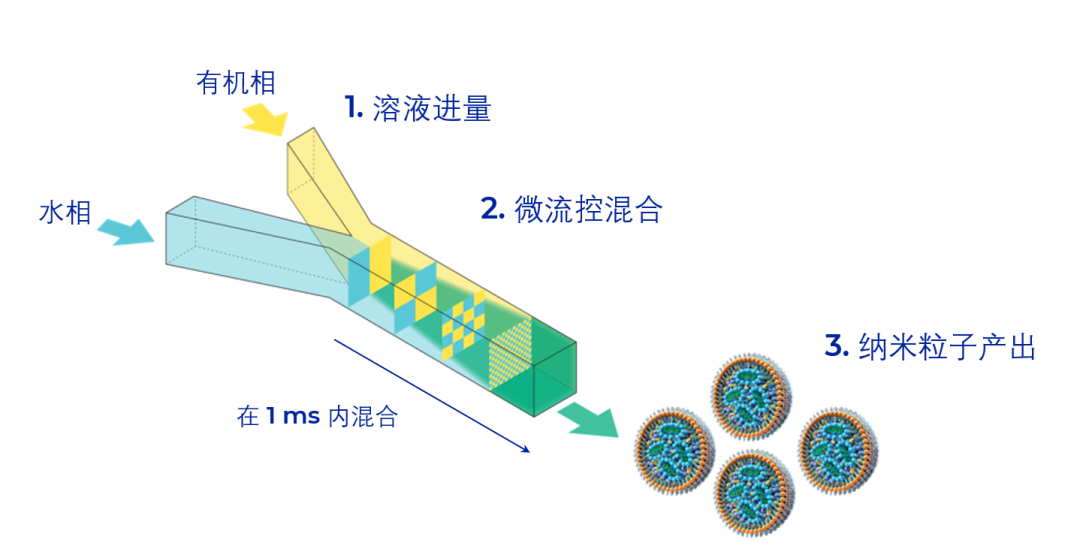
图 NxGen NanoAssemblr ® 微流控技术
NxGen 的层流混合技术可以确保形成均一,
可控和可重复的纳米颗粒。
mRNA-LNP浓缩换液
微流控技术制备好LNP后,通常需要快速稀释以降低有机溶剂浓度,以确保LNP的稳定性,此步可以直接在PNI的制备设备上完成; 之后需要采用超滤技术进行浓缩换液,充分去除有机溶剂的同时将LNP置换到制剂溶液环境中。
浓缩换液如果采用传统的切向流超滤TFF技术,无论是中空纤维还是超滤膜包,主要的潜在风险是上游料液在浓缩过程中始终在上游流路中循环,会长时间承受泵、管路和超滤设备的剪切力作用,其积累效果对LNP结构的损伤不容忽视。PALL拥有Single Pass TFF技术,通过膜结构的内部改变,使料液在膜包内单向流动一次,在回流端获得浓缩后的料液,通过增加流路长度达到浓缩效果。这种技术大幅度降低了料液循环次数,并大大降低膜包剪切力,对剪切比较敏感的LNP、蛋白、病毒等具有保护作用。已经在国内多家测试成功,采用多次稀释-SPTFF浓缩即可以成功实现LNP的换液,对mRNA-LNP结构实现了最大程度的保护。

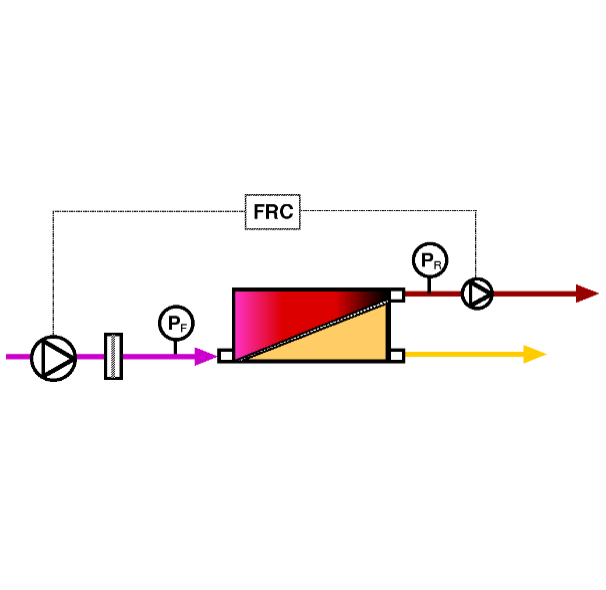
图 颇尔SPTFF单向流动模式
mRNA-LNP的除菌过滤
已报道结果【2】说明,脂质体及LNP等纳米料级药物,由于多种因素影响,存在除菌过滤工艺中细菌挑战无法达到10-6SAL的案例,需要慎重优化工艺、选择适宜过滤器、合理优化验证条件来确保除菌过滤工艺的顺利实现。
对此,颇尔推荐选择适宜于复杂流体的除菌过滤器,如Supor® EKV, Supor® ECV, Fluorodyne® EX EDF滤器系列,这些系列共同特点之一是采用了双层膜结构,上层为不对称渐变结构,对于复杂流体具有更好的滤速与处理量;与下层对称膜结合,可以更好地实现无菌保障。

图 颇尔可应用于mRNA-LNP的除菌过滤器
mRNA-LNP的小体积工艺验证
除菌过滤工艺验证中,药品使用量(常规用量为5~8L)始终是药物开发商最重要的成本,对于mRNA-LNP药物来说,这一瓶颈更为明显。对此颇尔于2022年初推出了改良后的验证方案,充分利用药物开发商已有数据,合理改进设备及试验流程,将使用药品体积缩减到165~500mL,帮助药物开发商显著降低了成本,并有可能加快药物申报或上市速度。
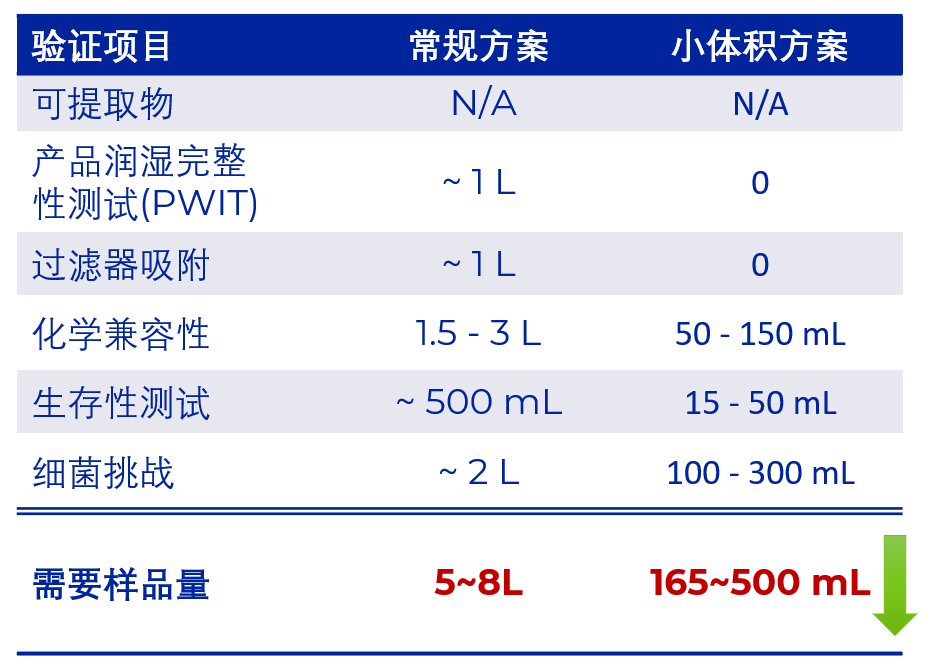
图 颇尔常规工艺验证与小体积工艺验证所需样品量对比:
小体积工艺验证样品量只需165-500ML
除菌过滤工艺中的PUPSIT
目前国内外上市或进及临床的mRNA药物大多数为新冠疫苗或其它疫苗,这些药物的GMP生产工艺如果申请WHO预认证,需要考虑终端除菌过滤器使用前灭菌后完整性检测(PUPSIT)的应用。在GMP要求下、一次性工艺中实施PUPSIT,建议最终用户与供应商进行深度沟通,充分考虑IT检测方法、产品/水润湿、过滤器与RABS/隔离器位置、下游环境、冗余过滤等因素,并基于QbD原理及风险转移策略细致决定系统设计、使用点泄漏检测方法、验证、操作员培训等要素,从而将PUPSIT的风险降至最低,确保工艺安全。颇尔可提供从手动到全自动的除菌过滤PUPSIT设计的系统与耗材,以及相关工艺经验咨询服务。

图 颇尔终端除菌解决方案
综上所述,在mRNA药物的后段工艺,颇尔提供完整的LNP制备、纯化、除菌过滤解决方案,丹纳赫旗下多家公司同时提供相关质量控制的关键技术,为mRNA药物的快速发展提供最大程度的帮助。
为了助力mRNA更快更好发展,颇尔将于5月24日举办:

SPTFF在mRNA生产平台技术应用私享会
会议看点
SPTFF在mRNA平台应用
SPTFF技术优势及案例分享
报名方式
1.扫描下方海报二维码进行报名或联系销售进行报名
2.此会议仅限生产企业参加,报名审核通过后颇尔客服会及时与您联系
3.会议联系人:戚先生 186 2196 0187

引用:
1.Evolution of the market for mRNA technology,Nature Reviews Drug Discovery 20, 735-736 (2021)
2.https://www.pall.com/en/biotech/webinars/sterile-filtration-complex-fluids.html


