
摘要
本应用简报介绍了一种体外生物检测工作流程,该流程使用安捷伦 Seahorse XF 细胞能量代谢分析仪来测量地表水样品和各种有机化学物质(包括被视为线粒体毒性物质的农药)对代谢功能的影响。我们提出了 3 种实验设计来检测和定量分析样品(化学物质或水提取物)对 HepG2 细胞耗氧率 (OCR) 的影响,以区分 3 种不同的线粒体毒性机制:抑制 ATP 合酶、破坏电子传递链和质子梯度解偶联。将得到的 OCR 时间曲线用于创建所有 3 个终点的浓度-响应曲线,并推导出达到强效 ATP 合酶抑制剂、电子传递链抑制剂或解偶联剂所引起的最大效应的 10% 所需的浓度。我们评估了该工作流程对已知线粒体毒性机制的环境污染物的适用性,包括:除草剂溴苯腈、杀菌剂嘧菌酯和唑菌胺酯,以及抗微生物剂三丁基锡。该工作流程确认了所测试污染物的主要毒性模式。分析验证后,还对废水处理厂下游的河水样品进行了测试。该工作流程能够揭示真实地表水样品中由于解偶联和电子传递链抑制作用而产生的线粒体抑制效应。
前言
对于日常使用的成千上万种化学品,我们对它们的暴露和毒性信息的了解非常有限。体外生物检测可以增强对环境样品中化学物质的生物活性及其潜在环境影响的了解,同时还可以对它们进行优先级排序,以便于监管。此外,体外检测越来越多地用于毒理学检测,以补充多生物体和全生物体检测。与传统检测相比,体外检测更经济、更省时,为风险评估研究和常规环境监测提供了极大的优势。
线粒体在真核生物的细胞生理学功能中发挥着重要作用,负责大部分细胞能量的产生。我们知道环境污染物会通过 3 种方式干扰线粒体的能量产生:(1) 干扰三磷酸腺苷 (ATP) 合酶;(2) 使线粒体内外膜解偶联,从而干扰产生 ATP 所需的质子梯度;(3) 抑制产生电子传递链电化学梯度的蛋白质复合物(图 1)。
本应用简报以 HepG2 细胞为例介绍了一种体外检测工作流程,该流程使用安捷伦Seahorse XF 细胞能量代谢分析仪来鉴定和测定各种化学物质与其对代谢功能的生物学影响之间的联系。该方法可以区分产生线粒体毒性的 3 种作用模式 (MOA),如图 1 所示。

图 1. 化学暴露引起的线粒体能量产生破坏机制包括干扰三磷酸腺苷 (ATP) 合酶、解偶联线粒体内外膜(这会干扰产生 ATP 所需的质子梯度)以及抑制产生电子传递链 (ETC) 电化学梯度的蛋白质复合物
安捷伦 Seahorse XFe96 分析仪旨在以 96 孔板形式检测活细胞的耗氧率 (OCR),这是线粒体呼吸、糖酵解和 ATP 产生速率的关键指标。XF 分析仪可实现化合物添加和混合,无标记分析检测,以及实时自动检测 OCR。有关本应用简报中介绍的方法的更多详细信息,请参阅补充出版物 Mitochondrial Toxicity of Selected Micropollutants, Their Mixtures, and Surface Water Samples Measured by the Oxygen Consumption Rate in Cells[1]。使用细胞检测法来测定化学暴露对线粒体的影响已经过爱尔兰环保局(与安捷伦旗下的 Luxcel Biosciences 合作)验证[2]。同样,美国国家环保局使用高分辨液相色谱/四极杆飞行时间(LC/Q-TOF) 技术,采用基于 Seahorse XF 的线粒体毒性检测验证了化学物质风险评估的非靶向分析方法[3]。
通用方法
所有实验均分为 4 个时间段,如图 2 所示,图中还显示了阳性对照。在每个实验中,在第 1 时间段通过 3 个测量周期测定了基础呼吸。一个测量周期包括 3 分钟的细胞 OCR 测定和 3 分钟混合(通过上下移动探针实现)。然后添加寡霉素(一种 ATP 合酶抑制剂),并在第 2 时间段进行 9 个周期的 OCR 测定,对应的孵育时间为 54 分钟。更长的孵育时间有助于提高 ATP 合酶抑制剂的检测可靠性,并确保细胞有足够的时间摄取这些物质。在第 3 时间段开始时,添加 80 μmol/L 解偶联剂 2,4-二硝基苯酚 (2,4-DNP)(使OCR 达到最大值的 95%),并进行 3 个周期的 OCR 测定。
在第 4 时间段开始时,添加 0.5 μmol/L 鱼藤酮和抗霉素 A (Rot/AA),完全抑制电子传递链,并再次进行 3 个周期的 OCR 测定。在每个工作流程中,用所研究的化学物质或环境样品替换一种参比化学物质(寡霉素、2,4-DNP 或 Rot/AA),以考察所研究的化学物质或环境样品是否激活了相应的作用模式。一般来说,每个终点都是通过3 个测量周期得到的,但所研究的终点采用的是 9 个周期(每个周期为 3 分钟测量加 3 分钟混合)。在同一块 96 孔板中检测不同稀释倍数下的阳性对照、阴性对照和样品。为了简单起见,此处所有图仅显示一条曲线(即,一个孔的结果),但建议每个浓度水平下一式三份。

图 2. HepG2 细胞的 OCR 时间曲线(每个测量周期包括 3 分钟测量和 3 分钟混合)。细胞用寡霉素(测量 3 之后)、2,4-DNP(测量 6 之后)和 Rot/AA(测量 15 之后)处理,仅测量 6 之后的处理有所不同。黑色粗括弧表示时间段 1、时间段 2、时间段 3、时间段 4(OCR时间段1、OCR时间段2、OCR时间段3 和 OCR时间段4)
对照的动态范围定义为 2 个时间段 OCR 之间的差异,并根据基础呼吸(OCR时间段1)进行归一化。对于每种作用模式,阳性对照 ∆OCR阳性对照来自阳性对照细胞孔,阴性对照 ∆OCR阴性对照 来自同一时间段中未暴露的细胞孔。样品动态范围定义为阴性对照的 OCR 和样品 ∆OCR样品 之间的差异。
然后使用公式 1 和相应作用模式的∆OCRi 来计算每种作用模式的 OCR 比值。有关每种实验设计的 OCR 比值计算的更多信息,请参阅 Müller 等人[1] 的文章。通过推导浓度-响应曲线来量化效应强度,用 EC50 表示,即达到每种作用模式的最大效应的 50% 所需的化学物质或样品浓度(公式 2)。如果未达到 50% 的效应,则使用线性模型评估浓度-响应曲线,并推导出 EC10[4]。

工作流程 1:抑制 ATP 合酶
如图 3A 所示,在每个实验中,在第 1 时间段进行了 3 个周期的基础呼吸测定。接下来,为了评估对 ATP 合酶的抑制作用,将 2 µmol/L 三丁基锡 (TBT)、安捷伦 Seahorse XF 检测液(阴性对照,抑制率为 0%)和 1 µmol/L 寡霉素(阳性对照)平行添加到细胞中。
如图 3A 所示,ATP 合酶抑制的 OCR 动态范围定义为:添加 Seahorse XF 检测液对细胞的抑制为 0%,添加 1 µmol/L 寡霉素对细胞的抑制为 100%。由于对电子传递链的抑制同样会降低 OCR,因此通过随后添加 80 µmol/L 2,4-DNP 来评估对 ATP 合酶的抑制效应的特异性。如果暴露于样品的细胞在第 3 时间段中OCR 的增加程度没有达到添加 80 µmol/L 2,4-DNP 时观察到的增加程度,则可以得出结论:样品中的化合物抑制的是电子传递链,而不是抑制 ATP 合酶。如果干扰了电子传递链,则无法建立电化学梯度,因此无法解偶联。如图 3A 第 2 时间段所示,TBT 似乎还抑制了电子传递链。
∆OCRATP 合成抑制 使用公式 3 计算,ATP 合成抑制比值使用公式 1 计算。然后,通过公式 2 拟合 ∆OCRATP 合成抑制 与ATP 合酶抑制剂浓度,得出浓度-响应曲线(图 3B)。

图 3. (A) HepG2 细胞中 ATP 合酶抑制的 OCR 时间曲线。阳性对照(加入寡霉素,然后加入 2,4-DNP,接着加入 Rot/AA)的 OCR 曲线为黑色向上的三角形。阴性对照的 OCR 曲线为向下的空三角形。充当 ATP 合酶抑制剂的样品(2 µmol/L 三丁基锡,TBT)为绿色方块。(B) ATP合酶抑制剂 TBT 的浓度-响应曲线。3 个较高浓度下化合物过量,浓度-响应曲线中排除了这三个浓度(公式 2)

工作流程 2:氧化磷酸化解偶联
为了检测线粒体质子梯度解偶联效应,在第 1 时间段测量了 3 个周期的基础呼吸速率后,通过添加 1 µmol/L 寡霉素(100% 抑制)来降低 OCR。第 2 时间段增加了 OCR 抑制的动态范围(图 4A)。在第 3 时间段,将 80 µmol/L 2,4-DNP 添加到阳性对照孔中,将 Seahorse XF 检测液添加到阴性对照孔中,将样品添加到样品孔中,并在 54 分钟内进行 9 个周期的 OCR 测定。同时添加 80 µmol/L 2,4-DNP,确定了效应上限水平(阳性对照,黑线),添加培养基确定了无效应水平(阴性对照,绿线),如图 4A 所示。在第 4 时间段,添加 0.5 µmol/LRot/AA,并进行 3 个周期的 OCR 测定。
羰基氰-对-三氟甲氧基苯腙 (FCCP) 或2,4-DNP 可以使质子通过膜屏障而不产生ATP,从而解偶联质子梯度。尽管本实验中使用 2,4-DNP 作为参比解偶联剂,但FCCP(安捷伦 Seahorse XF 细胞线粒体压力测试试剂盒中有提供)是一种广受认可的替代品,可用于该工作流程。

使用与之前描述的相同类型的实验对解偶联效应进行定量,但如图 4A 所示,用样品取代阳性对照解偶联剂 2,4-DNP。使用公式 4 计算 ∆OCR解偶联,并使用常用方法计算线粒体膜解偶联比值。图 4B 显示了典型解偶联剂的浓度-响应曲线,以及得出的 EC50。由于最高浓度会导致信号猝灭,因此可以选择评估低效应水平的线性浓度-响应曲线,Müller 等人[1] 对此进行了更详细的介绍。

图 4. (A) HepG2 细胞中解偶联的 OCR 时间曲线。阳性对照(加入寡霉素,然后加入 2,4-DNP,接着加入Rot/AA)的 OCR 曲线用红点表示。阴性对照的 OCR 曲线为绿色三角形。作为解偶联剂的样品(例如溴苯腈)为蓝色方块。(B) 解偶联剂溴苯腈的浓度-响应曲线。3 个较高浓度下化合物过量,浓度-响应曲线中排除了这三个浓度(公式 2)
工作流程 3:抑制电子传递链
使用鱼藤酮和抗霉素 A (Rot/AA) 的混合物作为参比化合物来破坏电子传递链。为了测量电子传递链抑制效应,在测量了基础呼吸速率后向细胞中添加 1 µmol/L 寡霉素,以确保添加样品后 OCR 的任何下降都是由 ATP 合酶抑制引起的(第 2 时间段)。3 个测量周期后,添加 80µmol/L 2,4-DNP 以提高 OCR,从而增加动态范围。然后再额外进行 3 个周期的 OCR 测定(第 3 时间段)。在第 4 时间段中,将细胞暴露于样品、0.5 µmol/L Rot/AA 或 Seahorse XF 检测液(图 5A)。添加Rot/AA 后引起的 OCR 降低代表 100% 电子传递链抑制效应(阳性对照,图 5A 中的黑线),添加检测液后的 OCR 代表无抑制效应(阴性对照,图 5A 中向下的空三角形)。
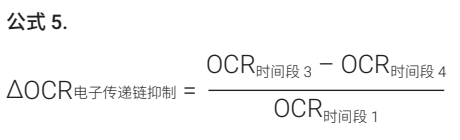
使用公式 5 计算 ∆OCR电子传递链抑制,并计算电子传递链抑制比值,得出图 5B 所示的浓度-效应曲线(以嘧菌酯为例)。
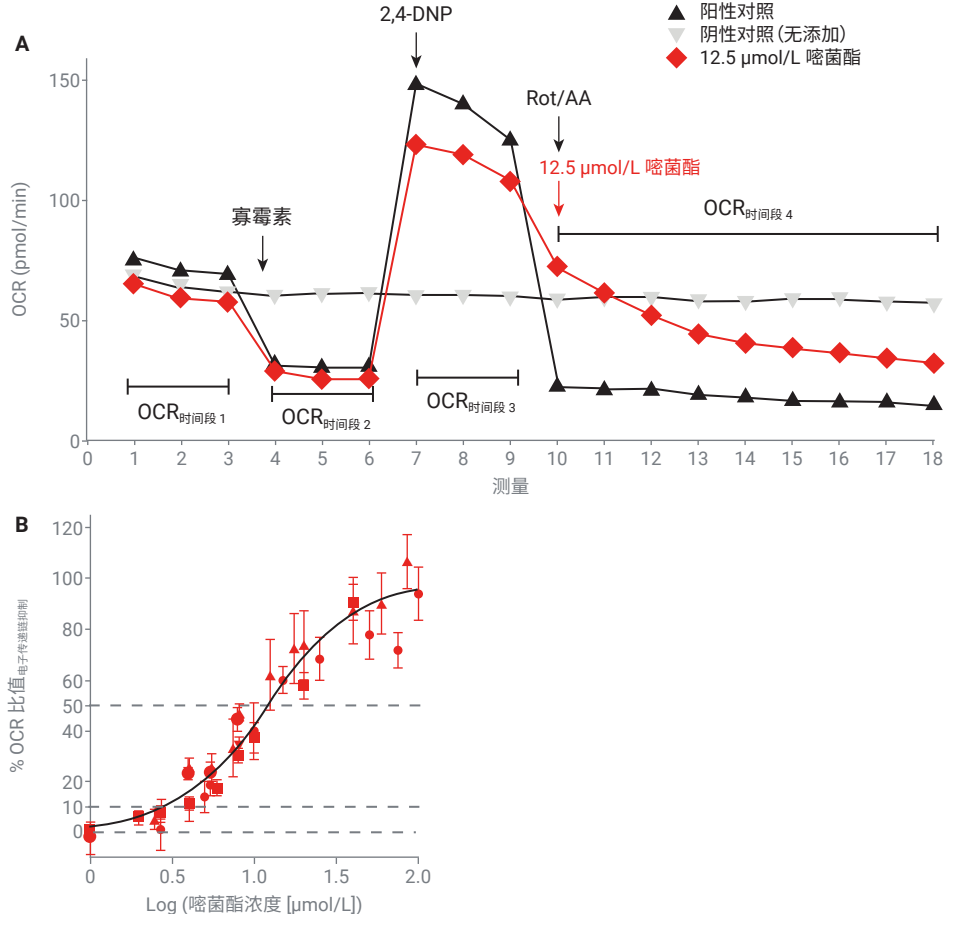
图 5. (A) HepG2 细胞中电子传递链抑制的 OCR 时间曲线。阳性对照(加入寡霉素,然后加入 2,4-DNP,接着加入 Rot/AA)的 OCR 曲线为黑色向上的三角形。阴性对照的 OCR 曲线为向下的空三角形。(B) 电子传递链抑制剂的浓度-响应曲线(红色符号,不同的符号代表独立实验)。黑线为浓度-响应曲线(公式 2)
该方法在化学物质评估中的应用
评估的样品中的化合物是地表水中常见的受监管的环境污染物,即除草剂溴苯腈,以及杀菌剂嘧菌酯和唑菌胺酯,详细信息请参阅 Müller 等人[1] 的文章。
表 1 汇总了所测试的化学物质在不同浓度下对 OCRs 的影响。从 CRC 线性部分确定的 EC10 值在从 S 型对数 CRC 推导出的 EC10 的 95% 置信区间内。低标准偏差表明 5 次独立的重复具有出色的重现性,证实线性 CRC 评估是一种合适的方法。溴苯腈、2,4-DNP、嘧菌酯和唑菌胺酯获得的结果显示出高精密度和重现性,证实使用 Seahorse XFe96 分析仪开展的实验适用于对各种化学物质进行评估。
TBT 等有机锡化合物广泛用作抗微生物剂,特别是用作船舶的防污涂料。它们以多种方式干扰线粒体中的氧化磷酸化,并抑制电子传递、解偶联线粒体膜,以及抑制 ATP 合酶。
使用工作流程 1 测试 TBT 相对于 1 µmol/L 寡霉素的 ATP 合酶抑制效应(图 6A,左侧 Y 轴,红色)。当浓度高于 2 µmol/L 时,似乎达到了最大效应水平的 50% 左右,当浓度进一步增加时,未超过该效应水平。如果采用工作流程 3 测试 TBT,还观察到对电子传递链的明显抑制效应(图 6A,右侧 Y 轴,蓝色)。如果直接比较 ATP 合酶和电子传递链抑制效应的浓度-响应曲线(图6A),它们具有相同的形状,在较低效应水平下呈 S 型曲线,而当 TBT 高于 2 µmol/L 时出现平台期。
表 1. 从 S 型对数 CRC 和 CRC 的线性部分计算出的各个化学物质的 EC10 值汇总


图 6. (A) TBT 的 ATP 合酶抑制(左侧 Y 轴,红色三角形)与电子传递链抑制(右侧 Y 轴,蓝色圆)的浓度-响应曲线。(B) TBT 的 ATP 合酶抑制(左侧 Y 轴,红色三角形和圆形,不同符号表示独立实验)与解偶联效应(右侧 Y 轴,蓝绿色三角形和圆形,不同符号表示独立实验)的浓度-响应曲线的比较
还使用工作流程 2 测试了 TBT 的解偶联活性。OCR 比值解偶联以浓度依赖性方式下降(图 6B 中的右侧 Y 轴,蓝绿色数据点)。
即使在已经达到 OCR 比值 ATP 合酶抑制 平台期 (50%) 的 TBT 浓度下,OCR 比值解偶联仍随着 TBT 浓度的增加而继续降低。
TBT 的示例表明,可以使用不同的 OCR 测量工作流程来区分解偶联和电子传递链抑制效应,但无法明确指出是 ATP 合酶还是电子传递链受到抑制。
在环境样品中的应用
此外,还检测了使用固相萃取 (SPE) 提取的来自德国阿默河 (Ammer River) 的水样。样品的相对富集系数 (REF) 通过公式 6 计算得出,即 SPE 提取和浓缩步骤中的富集系数 (EF) 与生物测定中样品的剂量系数 (DF) 的比值。富集系数可使用公式 7 计算得出,剂量系数可使用公式 8 计算得出。
大多数提取物显示无活性,但一种提取物(水提取物 A,图 7A)显示出较低的解偶联活性,但没有其他效应。由于效应未超过浓度的 30%,响应曲线呈线性,推导出 EC10。解偶联效应的 EC10 的 REF 为97.9 ±12.4 L水/L生物测定,这意味着必须将水样浓缩近 100 倍才能触发 10% 的效应。
另一种水提取物的 OCR 比值解偶联 显示无活性,但 OCR 比值电子传递链抑制 显示出明显的线性浓度-响应曲线(水提取物 B,图 7B)。同样,样品必须经过富集才能显示出效应。从浓度-响应曲线的线性部分得出的电子传递链抑制效应的 EC10 的REF 为 9.3 ±1.8,即样品必须富集 9.3 倍才能达到 10% 的效应。这是一个较低但不可忽略的效应。


图 7. (A) 水提取物 A 的 OCR 比值解偶联 的浓度-响应曲线。(B)水提取物B 的 OCR 比值电子传递链抑制 的浓度-响应曲线。REF = 相对富集系数,以L水/L生物测定 为单位。不同的符号表示独立的实验
Seahorse XFe96 分析仪方法的实验详情
将 Seahorse XFe96 探针板在 37 °C 的无菌水中孵育过夜。实验前至少 1 小时,将无菌水更换为 XF 校准液,并将探针板在相同条件下孵育直至开始测量。测量前将培养基更换为 Seahorse XF 检测液。吸出培养基,每孔留下 20 μL。向每个孔中加入补充有 10 mmol/L 葡萄糖、1 mmol/L 丙酮酸钠、2 mmol/L 谷氨酰胺和 5 mmol/L HEPES 的 Seahorse XF 检测液,每个孔的最终体积为 180 μL,并调整 pH 至 7.4(推荐培养基参见表 2)。此步骤重复 3 次。然后将微孔板在 37 °C 下孵育 1 至 2 小时。在每个实验中,通过加入参比化合物寡霉素 (10μmol/L)、2,4-DNP (0.8 mmol/L) 和 Rot/AA (5 μmol/L)(加药口 A&加药B&加药 C),获得参考(阳性对照)曲线。以 10 倍浓度制备阳性对照并加入孔中,以引起 ATP 合酶完全抑制、95% 解偶联和电子传递链完全抑制,作为与所有样品进行比较的阳性参考。
FCCP 是安捷伦 Seahorse XF 细胞线粒体压力测试试剂盒的一部分,是本研究中使用的参比解偶联剂 2,4-DNP 的广受认可的替代品。有关该试剂盒和安捷伦推荐用于该检测的材料的详细信息,请参阅本应用简报的“推荐材料”部分。根据所进行的实验,在每个时间段开始时添加样品和对照(图 2)。降低传感器探针并测量 OCR 3 分钟,然后通气 3 分钟,接着添加参比化合物并混合,生成OCR 曲线。然后比较通过平行测量获得的曲线,其中一种参比化合物替换为了样品或阴性对照。
为了表征相应化学物质抑制线粒体 ATP 合酶的效应,将目标化合物或样品以所需浓度加入加药口 A,而不不加入寡霉素。为了评估对线粒体膜的解偶联效应,将样品以所需浓度加入加药口 B,而不加入2,4-DNP。为了评估对线粒体电子传递链的抑制效应,将样品加入加药口 C,而不加入 Rot/AA。由于 OCR 随时间恢复至基础呼吸,因此在同一块孔板中添加了阴性对照孔。对于阴性对照孔,在加药口A、加药口 B 或加药口 C 加入 Seahorse XF 检测液,而不加入寡霉素、2,4-DNP 或 Rot/AA。该微孔板包括处理阳性对照(加药口 A,寡霉素;加药口 B,2,4-DNP;加药口 C,Rot/AA)、阴性对照(加药口 A、B 或 C 加入检测液,而不加入寡霉素、2,4-DNP 或 Rot/AA)、样品(分别加入加药口 A、B 或 C,而不加入寡霉素、2,4-DNP 或 Rot/AA)、背景(不含细胞但与阳性对照进行了相同处理的孔)和检测液背景(加药口 A、B 和 C 加入检测液)。平行加入样品与阳性对照和阴性对照后,在 54 分钟内进行 9 个周期的 OCR 测定,以确保有足够的时间让样品进入细胞并影响线粒体功能。
结论
本实验证明,Seahorse XFe96 分析仪OCR 工作流程适用于鉴定环境水基质的线粒体毒性效应。通过已知线粒体毒性机制的各个化学物质的分析结果验证了该工作流程。阿默河样品的分析结果表明,该工作流程能够识别出采样点 1 样品的解偶联效应和采样点 2 样品的电子传递链抑制效应。针对这一结果的一种解释是,两个位点之间的一条支流引入了一种可抑制电子传递链的杀菌剂。该结论必须通过化学分析来证实。总体而言,使用Seahorse XFe96 分析仪的高通量 EDA 提供了一种快速、经济高效的工具,可以帮助研究人员更好地了解环境样品中存在的化学物质及其生物活性。
推荐材料
表 2. 推荐材料

缩写词
2,4-DNP:2,4-二硝基苯酚
ATP:三磷酸腺苷
DF:剂量系数
EC10:10% 抑制效应浓度
EC50:半最大效应浓度
EF:富集系数
ETC:电子传递链
FCCP:羰基氰-对-三氟甲氧基苯腙
LC/Q-TOF:液相色谱/四极杆 TOF
MOA:作用模式
OCR:耗氧率
REF:相对富集系数
Rot/AA:鱼藤酮和抗霉素 A
SPE:固相萃取
TBT:三丁基锡
参考文献
Müller, M. et al. Mitochondrial Toxicity of Selected Micropollutants, Their Mixtures, and Surface Water Samples Measured by the Oxygen Consumption Rate in Cells. Environ. Toxicol. Chem. 2019, 38, 1000–1011
Papkovsky et al. Development of a Novel Environmental Monitoring System based on Optical Oxygen Sensing and Respirometry, (AT-04-01-01) EPA IE, 2009
Sobus et al. Integrating Tools for Non-Targeted Analysis Research and Chemical Safety Evaluations at the US EPA. Journal of Exposure Science & Environmental Epidemiology 2018, 28, 411–426
Escher, B. et al. The Advantages of Linear Concentration-Response Curves for In Vitro Bioassays with Environmental Samples. Environmental Toxicology and Chemistry 2018, 37(9), 2273–2280

仅供科研使用,不用于临床诊断用途。

长按识别二维码, 关注安捷伦细胞分析