随着质谱技术的不断发展,内源性代谢物和外源物质的检测和鉴定已经发展到涵盖代谢途径表征,疾病诊断[1],代谢谱分析[2],生物标志物发现[3]和环境暴露评估[4]等各方面。由于90%以上的人类疾病是涉及遗传和环境因素以及二者互作[5-8],外源物质(如药物和环境污染物)的监测作用进一步凸显,但是,每人每天接触超过一千种化学物质,并且它们的浓度范围(即飞摩尔至毫摩尔)和分析基质(例如血浆,尿液和唾液)存在不确定性,因此对这些化学物质进行分析或对暴露进行全面表征很困难。因此,开发具有更高通量和分离效率并且对样品制备和衍生化的依赖性降低的分析仪器对于将来的代谢组和暴露组研究至关重要。
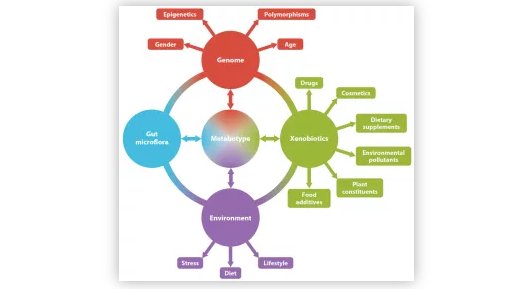
个体间的基因组,环境暴露和肠道菌群变异可能会导致个体特异性代谢型或代谢组学指纹。 这些因素中的每一个都可以影响其他因素,并确定代谢型的结果。 相反,个体的代谢组会影响每个因素。(图片来源:Johnson, Caroline H., et al. Annual review of pharmacology and toxicology 52 (2012): 37-56.)
气相色谱-质谱(GC-MS)[9]和液相色谱-质谱(LC-MS)[10]在代谢物质分析方面有广泛使用。二者在高灵敏度和多维分子表征方面都有突出优势,但是传统的一般通量(每小时1-5个样品)限制分离速度和处理大量同类样本的能力:对于液相色谱-质谱,小分子的性质多样性使得在分析时通常需要使用多种色谱柱填充材料和相应的流动相;而对于所有质谱方法,化学物质对不同离子源以及正电离和负电离模式的选择也是一个挑战。目前,应对上述难题的最佳方案是利用 IMS(ion mobility spectrometry) 与 MS 相结合,IMS-MS 可在一次运行中对每种内源性代谢物或外源物质直接进行结构和质量分离[11]。IMS-MS 优势可在一秒内区分化合物空间异构体[12], 并利用固相萃取(solid-phase extraction, SPE) 技术与 IMS-MS相结合从复杂混合物中线上净化分离目标分析物。近日,美国太平洋西北国家实验室的研究人员与合作者在 Clinical Mass Spectrometry 上发文“SPE-IMS-MS: An automated platform for sub-sixty second surveillance of endogenous metabolites and xenobiotics in biofluids”。研究人员利用提出了一种用于小分子超快速淌质谱分析生物样品的全动化平台,该平台通过将固相萃取(SPE)与 IMS-MS相结合,以高重现性(CV⩽3%)、高灵敏度(pM 范围)和超高通量(样品间间隔 10 s, 每天可运行超过生物样品8000)对人类体液中的内源性代谢物和外源物质进行靶向和全局监测。同时,研究人员使用人类血浆和尿液样本证明了该平台的实用性,并对 1 型糖尿病(T1D)个体病例进行了对照研究。

此篇文章使用多个 SPE 柱,采用 Agilent RapidFire 365 高通量质谱系统构建了自动化固相萃取(SPE)系统,并将 RapidFire 365 SPE 系统与 Agilent 6560 IMS LC/Q-TOF 系统连接,使该系统能超快速自动化对同一样本进行化合物淌度质谱监测。每个 SPE-IMS-MS 分析过程均经过优化,以实现 10 秒的样品超快速分析。以果糖 6-磷酸、葡萄糖 6-磷酸和葡萄糖 1-磷酸的分析为例,它们均是糖酵解通路上的重要化合物,许多科研专家都会检测这条通路对于生物样品的变化。使用 SPE-IMS-MS 超快速分离系统能在短短 10 秒完成葡萄糖 6-磷酸和葡萄糖 1-磷酸同分异构体分离,可大大加快分析速度、提高样品通量、确保生物样品检测结果的真实性(如图 3 所示)。到目前为止,可以认为自动化 SPE 系统与 IMS LC/Q-TOF 结合的超快速生物样品分析系统是目前研究复杂生物样品速度最快的分析手段。
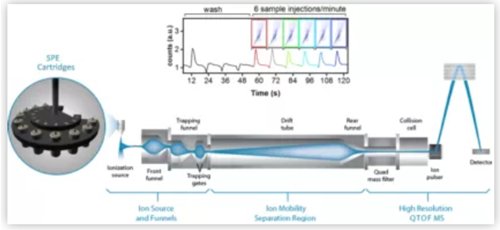
图2. 自动化 SPE 系统与 IMS LC/Q-TOF 超快速淌质谱分离系统结合的小分子分析工作流程。
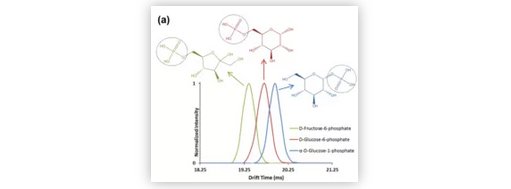
图3. 此系统超快速分离糖酵解通路上果糖 6-磷酸、葡萄糖 6-磷酸和葡萄糖 1-磷酸这三个重要代谢物。
随后研究人员对系统进行了更深入的评测。对于目标物分析,本联合系统使用pM范围内的体液具有高度可重复性和灵敏性,同时使用同位素稀释法进行了样品定量。在体液研究中应用的多个 SPE 柱可按化学类别富集内源性代谢物和外源物质,以提供有关其化学组成的高灵敏度信息,同时仍保持超高通量。在针对受 T1D 影响的个体的全局性尿液病例对照研究中,IMS 分离过程结合有针对性的 MS/MS 分析,可帮助其识别出同分异构的小分子化合物,并揭示了以往与 T1D 病理相关的未知异构体丰度水平的变化。
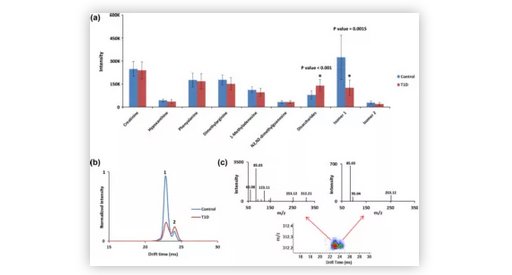
图4. a)T1D 和对照人员尿液样本中九种小分子的表征;b)T1D(红色)和对照(蓝色)的 IMS 结合 MS/MS 质谱(图c),揭示了异构体的不同特征强度
内源性代谢物和外源物质表征对于探究疾病的遗传和环境原因至关重要。本研究开发的这种超高通量 SPE-IMS-MS 平台和工作流程,可以对复杂的人类体液中的内源性代谢物和外源性化合物同时进行靶向和全局评估。SPE-IMS-MS 工作流程的超快速、高通量、高灵敏度和准确定性、定量功能可提供超快速执行代谢物分离和生物样品分析的能力。相信 SPE-IMS-MS 平台和工作流程能够克服大规模代谢组学的许多挑战,并为临床质谱研究和筛选人群和患者以深入了解疾病过程提供一条可行的途径。
参考文献
[1] A. Zhang, H. Sun, X. Wang, Serum metabolomics as a novel diagnostic approach for disease: a systematic review, Anal. Bioanal. Chem. 404 (4) (2012) 1239-1245.
[2] O. Beckonert, H.C. Keun, T.M. Ebbels, J. Bundy, E. Holmes, J.C. Lindon, et al., Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts, Nat. Protoc. 2 (11) (2007) 2692–2703.
[3] J. Xia, D.I. Broadhurst, M. Wilson, D.S. Wishart, Translational biomarker discovery in clinical metabolomics: an introductory tutorial, Metabolomics 9 (2) (2013) 280–299.
[4] B.K. Weis, D. Balshaw, J.R. Barr, D. Brown, M. Ellisman, P. Lioy, et al., Personalized exposure assessment: promising approaches for human environmental health research, Environ Health Perspect. 113 (7) (2005) 840-848.
[5] C.H. Johnson, A.D. Patterson, J.R. Idle, F.J. Gonzalez, Xenobiotic metabolomics: major impact on the metabolome, Annu. Rev. Pharmacol. Toxicol. 52 (2012) 37–56.
[6] E.J. Want, A. Nordström, H. Morita, G. Siuzdak, From exogenous to endogenous: the inevitable imprint of mass spectrometry in metabolomics, J. Proteome Res. 6 (2) (2007) 459–468.
[7] D. Thomas, Gene-environment-wide association studies: emerging approaches, Nat. Rev. Genet. 11 (4) (2010) 259–272.
[8] C.P. Wild, Complementing the genome with an ‘‘exposome”: the outstanding challenge of environmental exposure measurement in molecular epidemiology, Cancer Epidemiol. Biomarkers Prev. 14 (8) (2005) 1847–1850.
[9] M.M. Koek, R.H. Jellema, J. van der Greef, A.C. Tas, T. Hankemeier, Quantitative metabolomics based on gas chromatography mass spectrometry: status and perspectives, Metabolomics 7 (3) (2011) 307–328.
[10] G.A. Theodoridis, H.G. Gika, E.J. Want, I.D. Wilson, Liquid chromatography-mass spectrometry based global metabolite profiling: a review, Anal. Chim. Acta 711 (2012) 7–16.
[11] H. Suhr, Plasma Chromatography, Plenum Press, New York, 1984.
[12] J.C. May, J.A. McLean, Ion mobility-mass spectrometry: time-dispersive instrumentation, Anal. Chem. 87 (3) (2015) 1422–1436,