前言
病毒选择宿主的初衷是为了寄生,复制自己,所以它会进化以逃逸人体免疫系统,达到长久寄生以及在人际间传播的目的。
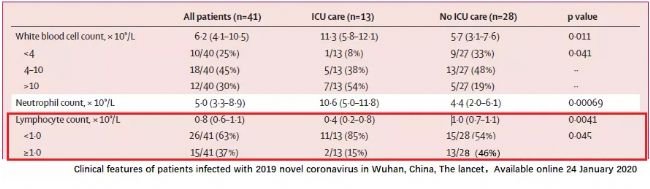
COVID-19病人临床资料,ICU重症病人,淋巴细胞计数远低于Non-ICU病人,提示病毒可能通过某些机制引起了淋巴细胞的减少。
恒瑞等启动了免疫检查点抑制剂新冠肺炎的临床。众所周知免疫检查点参与T细胞耗竭。
基于此,想谈谈免疫细胞凋亡,衰老,耗竭在病毒感染逃逸中的作用。
对于新冠肺炎病毒,现在并无明确定论的研究,不做讨论,避免产生误导。
以HCV为例来写本文。
HCV感染与诱导免疫细胞及肝细胞凋亡
HCV于1989年首次被确定为丙型肝炎感染的病原体,是一种属于Flaviviridae病毒科Hepacivirus属的RNA病毒。
越来越多的证据表明,病毒倾向于利用宿主细胞机制诱导组织或免疫细胞凋亡,作为延缓病毒特异性免疫反应,最终导致持续感染的一种途径。
一般来说,病毒利用死亡受体和非受体信号通路。
在受感染个体的细胞表面诱导促凋亡受体或其配体,作为诱导细胞死亡的手段,并最终持久化感染。在慢性HCV感染过程中,肝细胞通过上调死亡诱导配体CD95/FAS、TNF相关凋亡诱导配体(TRAIL)和肿瘤坏死因子α(TNF-α),诱导细胞凋亡。
另一项研究认为,某些HCV结构蛋白可以作为免疫调节剂,在肝细胞上上调FASL,使激活的外周T细胞通过caspase3激活发生凋亡,最终抑制抗病毒反应,以协助病毒的持久性感染。
HCV特异性CD8T细胞的丢失,可能会延缓HCV感染细胞的消除和病毒中和。
同时,HCV也通过非受体介导的线粒体凋亡途径。即caspase3的激活、活化caspase3的核易位、ROS的分泌和线粒体细胞色素c的释放。
免疫衰老(Immunosenescence)
在正常的人类衰老过程中,宿主免疫系统在对外来抗原的细胞反应方面的功能变得很差,导致幼稚的T细胞替换不良,并通过一系列称为免疫衰老的事件增加衰老表型T细胞的扩张。在正常衰老过程中,T细胞变得越来越容易受到免疫衰老的影响,从而导致功能幼稚T细胞库频率低下,幼稚T细胞向终末分化T细胞分化率增加,端粒缩短,CD4/CD8比值下降,缺乏CD28共刺激分子的记忆T细胞数量增加,导致感染、自身免疫性疾病、慢性炎症性疾病和癌症易感率增加。
已经证明某些慢性病毒感染,特别是HIV和HBV,通过一个被称为复制性衰老的过程,在免疫损伤方面起着明确的作用。机制是由于T细胞持续暴露于病毒蛋白导致慢性免疫激活(CIA),复制衰老的T细胞通常表现为共刺激分子(CD28和CD27)以及T细胞存活分子(CD127)表达水平较低。这些细胞一起也增加了CD57的表达,CD57是复制衰老的生物标记物,以及CD38和HLA-DR等慢性激活标记物的过度表达。

HIV研究显示,CD28+,CD27- CD4细胞亚群的出现是免疫衰老开始的标志。
慢性HCV感染的患者中也观察到了类似的现象,在这些患者中,出现了更高比例的效应衰老CD8+CD57+T细胞,这在肝硬化中似乎也明显更高。
免疫耗竭(Immune Exhaustion)
在病毒感染过程中,抗原提呈细胞(APC),如树突状细胞,将病毒衍生的肽抗原呈递给幼稚的CD4T细胞,进而产生IL-2、IFN-γ和TNF-α激活。这有助于短命的细胞毒性T淋巴细胞(CTLs)分化为记忆细胞和效应细胞CD8T细胞,最终通过分泌穿孔素和颗粒酶杀死病毒感染的细胞。
然而,有一种完全相反的现象称为T细胞衰竭,即在一些病毒感染的患者中,T细胞亚群的功能将受到损害,同时导致慢性炎症状态以及重复刺激T细胞。
CD8和CD4T细胞衰竭的另一个重要标志是抑制分子/阴性免疫检查点的上调,在感染腺病毒、HIV、HBV和HCV时,这些检查点与APCs上表达的同源配体结合。
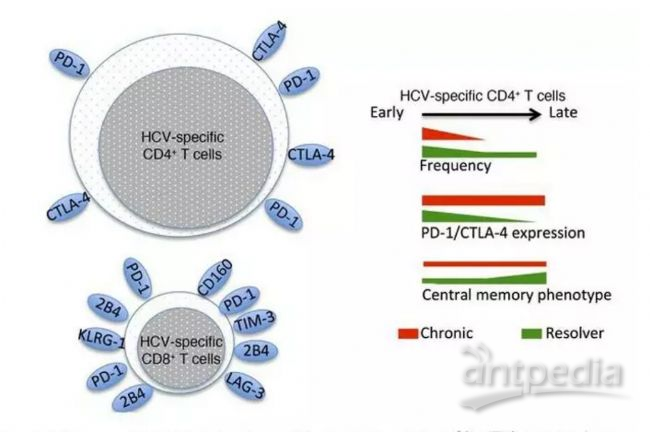
耗竭的T细胞表达一组共抑制分子(PD-1、TIM-3、CTLA-4、LAG-3、2B4、BTLA),除了转录抑制因子、BLIMP-1和Foxp3外,还显示出包括抗炎和促炎细胞因子(IL-2、TNF-α、IL-10和TGF-β)的独特模式。
研究表明,在急性感染时,PD-1在HCV特异性T细胞上的表达相对较高,并且很大一部分细胞在HCV感染的慢性阶段表达PD-1,尽管这与HCV疾病的临床结果无关。在另一项研究中,研究人员证明,肝硬化患者脾脏中的T细胞表达更高水平的PD-1和TIM-3,主要在效应记忆亚群体中表达。
PD-1可能在CD8T细胞功能障碍中起作用,导致病毒持久性感染。另一项关于慢性HCV感染中T细胞衰竭的研究表明,T细胞在急性感染后立即发生快速衰竭,连续丧失IL-2的产生、增殖和IFN-γ产生,并增加TIM-3、PD-1和CTLA-4的表达,并在此后持续较长时间。
MAIT(粘膜相关恒定细胞)的丢失是否有助于HCV的持久感染?
具有抗菌特性的特殊的、先天样的T细胞,称为粘膜相关恒定的T(MAIT)细胞,是人类进化保守的T细胞亚群,在系统循环中处于丰富的水平,占健康成人总t细胞库的1-8%。肺和肝组织中也可见MAIT细胞(约占肝脏T细胞的50%)
MAIT细胞与不变自然杀伤T细胞(INKT)具有表型相似性,表达高水平的IL-12Rβ2、IL-18Rα和CD161与半不变Vα7.2段。
这些细胞很容易被IL-12和IL-18以及一些外来抗原(微生物衍生的维生素b代谢物)刺激,它们是由单体MHC-I类相关蛋白(MR1),在共刺激分子CD80或CD86的帮助下呈现的,尽管MAIT细胞不是细胞介导的免疫反应的一部分。
激活后,MAIT细胞往往分泌广泛的细胞因子(IL-4、IL-5、IL-10、IFN-γ、TNF-α、IL-17和IL-22)或释放穿孔素以及颗粒酶,可杀死微生物感染的细胞。
最近的研究表明,虽然MAIT细胞对病毒感染起着关键作用,但它们不能直接识别病毒感染的细胞。然而,从感染细胞中释放出的几种先天细胞因子(IL-18、IL-12、IL-15和IFN-)对MAIT细胞有刺激作用,研究人员已经表明,MAIT细胞在慢性HCV感染过程中严重减少,并出现耗竭和衰老表型。慢性HCV患者的MAIT细胞除了PD-1、CD38和HLA-DR外,还表达高水平的CD57。
推测,在慢性HCV感染过程中,由于细胞的反复激活而导致外周MAIT细胞衰竭和衰老,可能导致先天防御属性减弱,从而导致病毒的持久性和HCV疾病的进展。
自然界很多规律或有相通之处。
参考文献
Chaolin Huang et al, Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China, The lancet,Available online 24 January 2020
Iannello, A.; Debbeche, O.; Martin, E.; Attalah, L.H.; Samarani, S.; Ahmad, A. Viral strategies for evading antiviral cellular immune responses of the host. J. Leukoc. Biol. 2006, 79, 16–35.
Iannello, A.; Debbeche, O.; Martin, E.; Attalah, L.H.; Samarani, S.; Ahmad, A. Viral strategies for evading antiviral cellular immune responses of the host. J. Leukoc. Biol. 2006, 79, 16–35.
Iken, K.; Huang, L.; Bekele, H.; Schmidt, E.V.; Koziel, M.J. Apoptosis of activated CD4+ and CD8+ T cells is enhanced by co-culture with hepatocytes expressing hepatitis C virus (HCV) structural proteins through FasL induction. Virology 2006, 346, 363–372
Barathan, M.; Gopal, K.; Mohamed, R.; Ellegård, R.; Saeidi, A.; Vadivelu, J.; Ansari, A.W.; Rothan, H.A.; Ravishankar Ram, M.; Zandi, K.; et al. Chronic hepatitis C virus infection triggers spontaneous differential expression of biosignatures associated with T cell exhaustion and apoptosis signaling in peripheral blood mononucleocytes. Apoptosis 2015, 20, 466–480
Saeidi, A.; Chong, Y.K.; Yong, Y.K.; Tan, H.Y.; Barathan, M.; Rajarajeswaran, J.; Sabet, N.S.; Sekaran, S.D.; Ponnampalavanar, S.; Che, K.F.; et al. Concurrent loss of co-stimulatory molecules and functional cytokine secretion attributes leads to proliferative senescence of CD8+ T cells in HIV/TB co-infection. Cell. Immunol.2015, 297, 19–32
Bucks, C.M.; Norton, J.A.; Boesteanu, A.C.; Mueller, Y.M.; Katsikis, P.D. Chronic antigen stimulation alone is sufficient to drive CD8+ T cell exhaustion. J. Immunol. 2009, 182, 6697–6708
Viral evolution and Immune responses,J Clin Microbiol Biochem Technol 5(2): 013-018
Raziorrouh, B.; Ulsenheimer, A.; Schraut,W.; Heeg, M.; Kurktschiev, P.; Zachoval, R.; Jung, M.C.; Thimme, R.; Neumann-Haefelin, C.; Horster, S.; et al. Inhibitory molecules that regulate expansion and restoration of HCV-specific CD4+ T cells in patients with chronic infection. Gastroenterology 2011, 141, 1422–1431.
CD8+ CD28 and CD8+ CD57+ T cells and their role in health and disease,Immunology, 134, 17–32 17
Diana Y. Chen, David Wolski,Jasneet Aneja,Lyndon Matsubara, Brandon Robilotti, Garrett Hauck, Paulo Sergio Fonseca de Sousa, Sonu Subudhi, Carlos Augusto Fernandes,Ruben C. Hoogeveen,Arthur Y. Kim, Lia Lewis-Ximenez, and Georg M. Lauer,Hepatitis C virus–specific CD4+ T cell phenotype and function in different infection outcomes ,J Clin Invest. 2020;130(2):768–773.