通过蛋白质组学技术对营养胁迫中泛素化修饰变化情况的分析与解读
Cell Death and Disease IF=5.965
Liver ubiquitome uncovers nutrient-stress-mediated trafficking and secretion of complement C3
研究背景
脊椎动物肝脏作为生物代谢的重要器官,在营养胁迫应答中发挥重要作用。在营养不足和营养过量时肝细胞会发生营养应激调控。肝细胞的营养应激会引发多种翻译后修饰变化,其中就包括泛素化修饰。本文通过蛋白质组学技术对营养胁迫中泛素化修饰变化情况进行了深入的分析与解读。
样本来源
小鼠肝脏
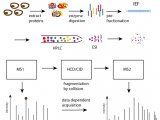
技术路线
研究结果
1、作者首先构建了饥饿/再投喂小鼠模型(fasting–refeeding),之后通过两种富集方法【Tandem Ubiquitin-Binding Entities 1 (TUBEs 1) 和 UbiQapture】富集其肝脏中泛素化修饰蛋白,酶解后利用LC-MS/MS进行蛋白组学分析,共鉴定到1641个假定的蛋白质组。
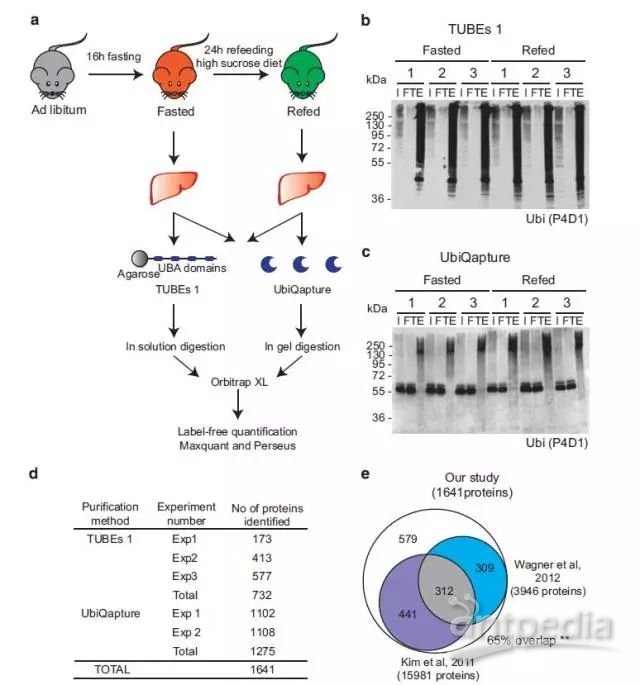
Figure 1 Identification of the ubiquitin-modified proteome in response to nutrient stress in the liver.
2、通过label free定量蛋白质组学分析,作者发现饥饿处理中26个蛋白的泛素化增加,在投喂后有91个蛋白泛素化增加;为了进一步验证蛋白的泛素化,作者在HEK293T细胞和小鼠原代肝细胞中对7个代谢相关蛋白泛素化修饰情况进行了检测,验证了组学的数据。
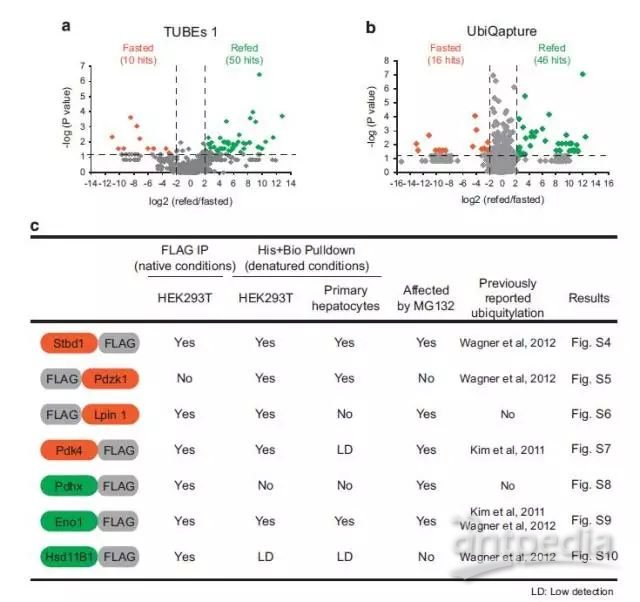
Figure 2 Fasting–feeding alters ubiqitylation patterns in the liver.
3、GO功能分析发现:这些差异修饰蛋白主要对位于线粒体,核糖体以及内质网中,主要参与代谢通路的功能;此外,在再投喂组差异修饰蛋白中还有16%位分泌蛋白,分布在ER的膜上和内部,而饥饿组差异修饰蛋白主要定位于胞液,线粒体和细胞核内。
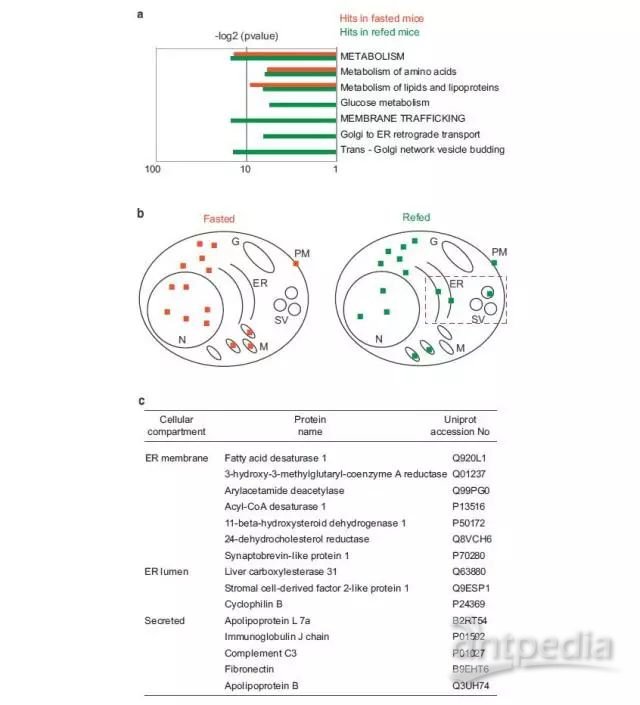
Figure 3 Liver ubiquitome identifies ER-resident and secretory proteins.
4、作者挑选出一个泛素化修饰差异的蛋白(Pro-C3,complement C3)在HEK293T细胞和小鼠原代肝细胞中进行后期的功能验证:发现Pro-C3的泛素化修饰与它的分泌和转运息息相关;进一步的细胞学实验发现Pro-C3蛋白的转运与分泌都受到营养胁迫的调控。
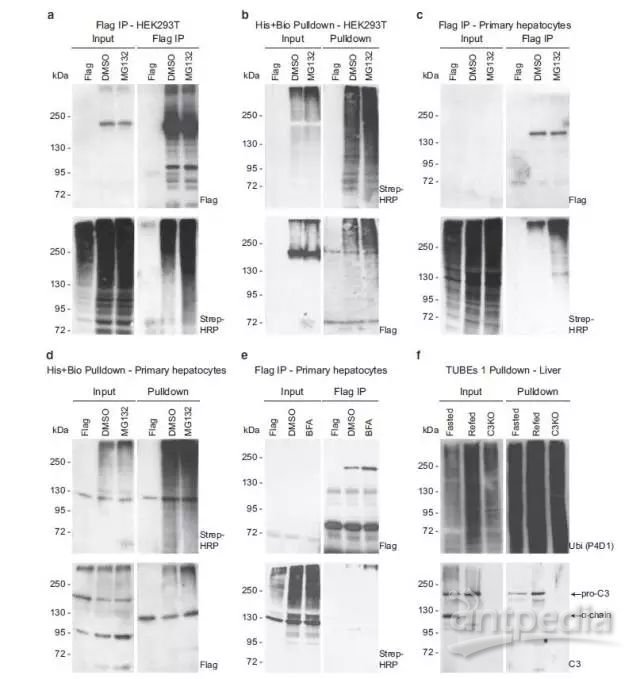
Figure 4 Pro-C3 is ubiquitylated in the livers of refed mice.
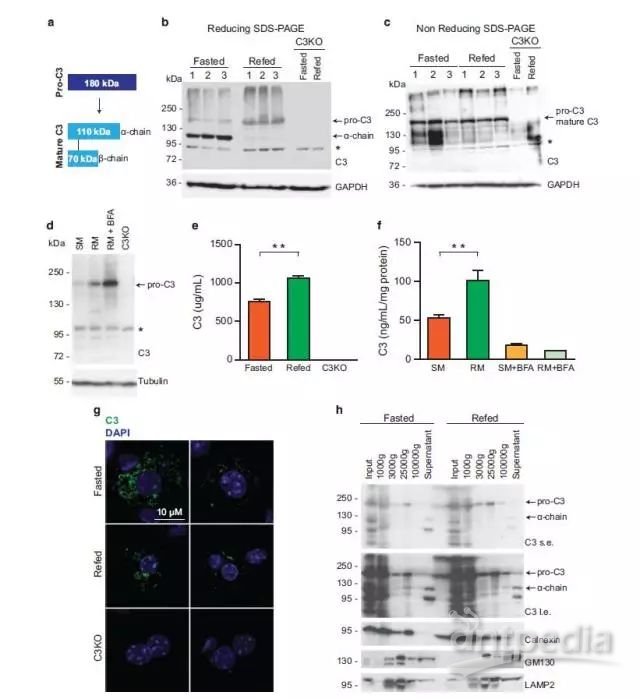
Figure 5 Mature C3 is stored in small vesicles and secreted upon nutrient overload.
5、作者在小鼠模型中验证了细胞学实验的结果,最后得到了一个分子机制模型:肝脏的营养情况会影响先天免疫因子的释放。
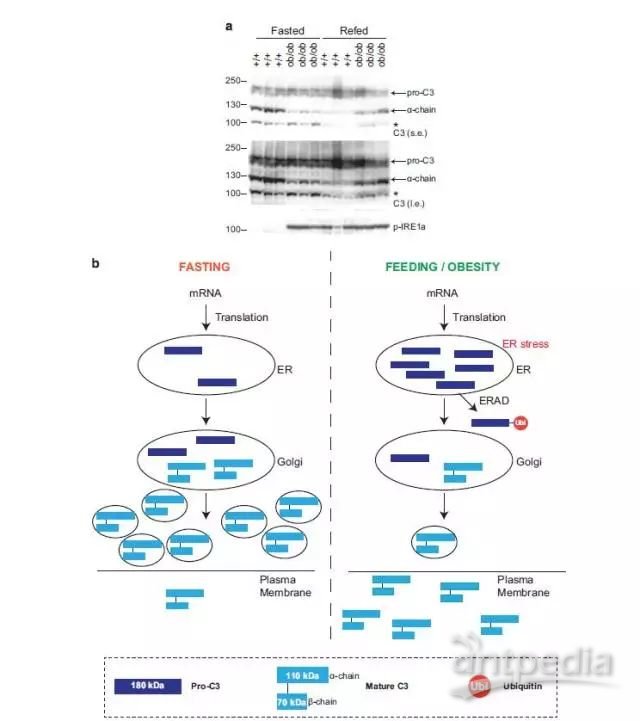
Figure 6 Acute and chronic nutritional stress accelerates trafficking of intracellular C3.
小编心得
本文是一篇典型前期组学筛选+后期功能验证的文章,前期利用非靶向的修饰蛋白质组学分析寻找生物样品中差异泛素化修饰的蛋白,后期通过在细胞以及生物体水平的功能分析验证泛素化修饰对蛋白功能的影响。
这篇文章也充分显示出了相比于转录组,修饰蛋白质组技术在机理研究的重要作用:转录组只能较为片面的反应蛋白表达趋势(这一点也要弱于普通蛋白质组),对蛋白翻译后修饰束手无策;基于质谱技术的修饰蛋白质组学技术不仅可以对单个蛋白的修饰位点(准确定位发生修饰的氨基酸)进行定性分析,而且可以对修饰程度进行定量分析。
看完这篇文章知道为什么要让大家少吃点了吧!那就从现在开始,少吃多动,成为一个健康的小吃货