2020年11月17日,Nature Communication(自然通讯)在线发表了北京大学医学部精准医疗多组学研究中心黄超兰课题组的研究成果:COVID-19疾病早期的免疫抑制(Immune suppression in the early stage of COVID-19 disease)。课题组使用基于质谱DIA定量蛋白质组学方法,采集了COVID-19感染病例和对照样本比较分析,发现了1986种蛋白质水平的变化,数据分析后表明免疫抑制和紧密连接(TJ)受损发生在COVID-19感染的早期,发现6种可用于COVID-19鉴别诊断以使其更精确的潜在生物标志物。将COVID-19患者进一步细分为中度和重度类型后的研究显示,在感染后期的重症患者中也发现了某种程度激活的免疫应答,并观察到两种特征蛋白质可能指示疾病阶段的转化。对于COVID-19这种不寻常的病毒感染发病机制,课题组提出“两阶段”的机理。
COVID-19的爆发已成为全球性的大流行病,目前尚不清楚这种传染病的发病机理以及与其他肺炎驱动因素的区别。在大流行初期,研究集中在重症和重症患者的管理和治疗上。统计显示,老年人特别是那些有潜在疾病,如心脏病、肺部疾病、肥胖症和糖尿病的老年人症状最严重。由于该病毒现已在全球传播,因此可以获得有关30至50岁年轻人感染者的更多信息。在越来越多的情况下发现,本来预期症状会改善,但却突然恶化。患者可在短时间内发展为急性呼吸窘迫综合征(ARDS),甚至突然死亡。这种突然的变化意味着疾病进展的“两阶段”模式,但是其潜在机制尚不清楚。
黄超兰课题组使用基于质谱的DIA(Data-independent Acquisition,数据非依赖采集)定量蛋白质组学方法来分析来自COVID-19感染病例、健康供体和非COVID-19肺炎病例的尿液样本。分子变化表明免疫抑制和紧密连接(TJ)受损发生在COVID-19感染的早期。将COVID-19患者进一步细分为中度和重度类型后的研究显示,在感染后期的重症患者中也发现了某种程度激活的免疫应答。对于COVID-19这种不寻常的病毒感染发病机制,课题组提出“两阶段”的机理。
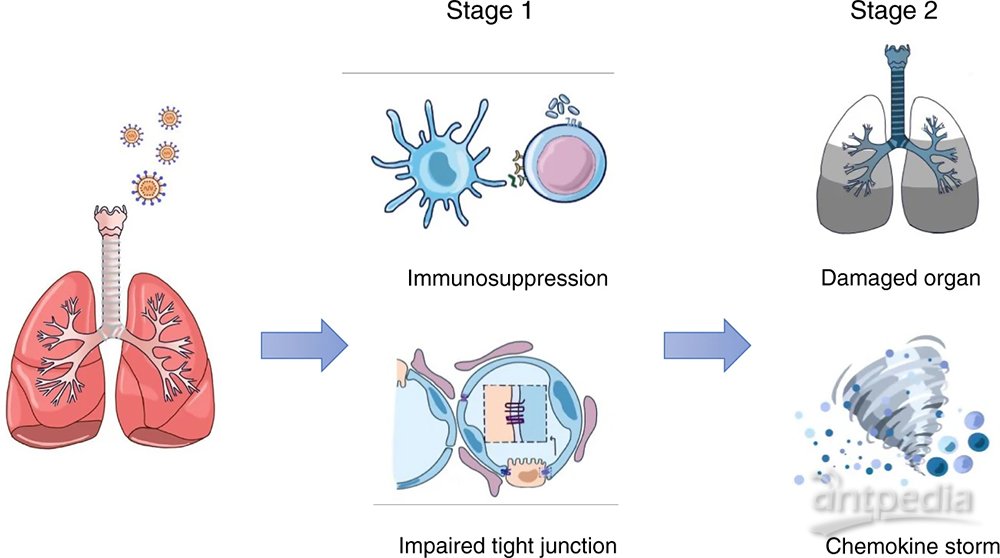
COVID-19发病机理的“两阶段”模型
COVID-19的第一阶段可能涉及抑制免疫系统和破坏紧密连接。第二阶段可能涉及激活的免疫反应,导致细胞因子风暴和器官损伤。
课题组主要用质谱技术进行数据采集和分析,这些数据提高了人们对COVID-19感染临床特征的了解,并为将来的机理和治疗研究提供资源。
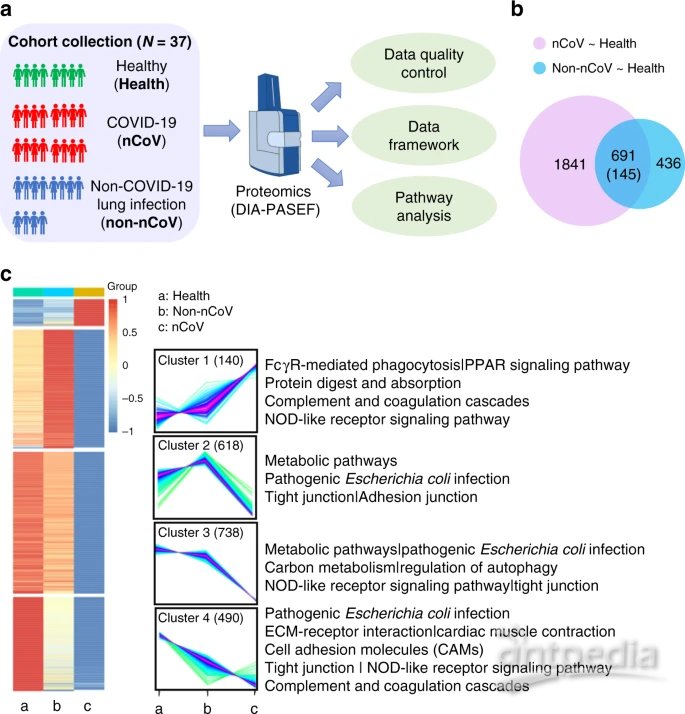
尿液蛋白质组学定量研究
a实验设计的说明。从三组中总共分析了37个尿液样本:健康对照(10个样本);和 COVID-19患者(14个样本);非COVID-19肺炎患者(13个样本)。DIA技术应用于定量蛋白质组学,该技术是通过布鲁克TIMS-TOF MS进行的,采用了并行累积-串行碎裂(PASEF)技术。集成数据分析涉及蛋白质表达,聚类和功能相关网络策略。
b蛋白质显着变化的维恩图(倍数变化的截止值> 2和倍数变化的<0.5; p值(t测试)(0.05)与健康对照组(COVID-19患者组(粉红色)和非COVID-19肺炎患者组(蓝色)相比)。与健康对照组相比,COVID-19患者中总共有1841种蛋白质发生了明显变化。两个疾病组中共有691个蛋白质发生了变化。在这691种蛋白质中,有145种蛋白质满足倍数变化> 2和倍数变化<0.5,p值(t检验)<0.05的条件。总共1986种蛋白质(1841种蛋白质和145种蛋白质)用于功能分析。
C COVID-19患者的蛋白质组学变化。比较健康对照、非COVID-19患者、COVID-19患者中1986种蛋白的热图。从红色到蓝色的颜色条代表在每组中识别的所有蛋白质从增加到减少的倍数变化。层次聚类根据相似性显示出清晰的组区分。指示了标记簇的蛋白质数量,强度分布和所选的丰富的KEGG途径。颜色条表示Z分数从-1到1的变化。
质谱分析实验表明,在所有37个样品中总共鉴定出5991个蛋白质,比较发现其中主要差异是1986种蛋白质水平的变化。在COVID-19组中发现,下调的蛋白质比上调的蛋白质高近十倍。KEGG(《基因与基因组京都百科全书》)富集分析揭示了与COVID-19感染相关的分子全景,发现十多个途径发生了显着变化,尤其是COVID-19对免疫相关途径,TJ途径和代谢途径有强烈影响。
研究发现COVID-19患者中,大量与免疫反应相关的蛋白质被下调,比如显著下降的蛋白酪氨酸磷酸酶受体C,瘦素和抗酒石酸酸性磷酸酶5,表明在COVID-19患者中免疫应答被抑制。此外,补体( Complement )C3,补体C1q亚基C,补体C1r亚基和PZP样含α-2-巨球蛋白结构域蛋白8被下调,表明补体系统明显受损。FcγR介导的吞噬作用中涉及的脾酪氨酸蛋白激酶水平显着降低,表明微噬细胞,嗜中性粒细胞,自然杀伤细胞和单核细胞的吞噬作用受到抑制。此前据报道,在COVID-19患者从轻度疾病过渡到重度疾病的过程中,血清中载脂蛋白AI水平降低,研究也观察到COVID-19患者中载脂蛋白A-IV(APOA4)和载脂蛋白E的下调,可能与巨噬细胞功能有关。
研究还观察到COVID-19患者中,与趋化因子信号通路相关的蛋白质水平降低,表明单核细胞活化,B细胞迁移和T细胞介导的免疫反应降低。还下调了2型中性粒细胞趋化因子CXC趋化因子受体,3、5B和6信号转导和转录激活因子的下调,提示了中性粒细胞、巨噬细胞和T淋巴细胞的细胞因子生成和脱粒受损。
急性缺氧和ARDS是COVID-19患者高病死率的两个主要原因。先前的研究表明,肺泡上皮屏障通透性的显著增加会导致肺泡水肿和渗出液形成,并且是导致ARDS低氧血症的主要因素之一。肺上皮的屏障功能取决于一组TJ异源复合物,这些复合物可密封相邻上皮细胞之间的界面。紧密连接(TJ)也存在于其它器官如肠、肾、脑和上皮细胞之间。TJ复合物的破坏是病毒感染过程中上皮屏障破坏的主要原因。研究发现,在COVID-19患者中,许多涉及TJ形成和细胞-细胞粘附连接的蛋白被下调,表明该病毒可能会在病毒入侵期间改变细胞间TJ的形成和上皮形态发生;反过来可能破坏保护下面组织的物理屏障。
在COVID-19患者尿液中显著上调或下调的蛋白质中,金属硫蛋白-1G、脂蛋白脂肪酶、β2M、PRKACA、FOLR2和APOA4变化显著,这些蛋白是用于COVID-19鉴别诊断以使其更精确的潜在生物标志物。值得注意的是,六种蛋白质中有四种与免疫应答和TJ相关,这是在COVID-19患者中鉴定出的两个重要途径。
据悉,细胞因子风暴发生在COVID-19例晚期。要了解COVID-19的发病机理,必须找出在疾病发展过程中过渡如何发生。为了对此进行进一步调查,将COVID-19患者分为9例中度病例和5例重症病例。PCA揭示了中度和重度COVID-19患者样品的良好分离。基因本体论富集分析表明,大多数上调的蛋白质都参与补体和凝血级联反应,自然杀伤细胞介导的细胞毒性和血小板活化。详细研究中度和重度亚组,发现在疾病晚期一定程度上出现了激活的免疫反应,而免疫抑制作用仍处于早期。疾病晚期阶段免疫应答被激活的结果与COVID-19患者严重和关键阶段的过度免疫反应、后期阶段病人出现细胞因子风暴的情况一致。研究还鉴定了两种特征蛋白,即免疫球蛋白λ变量3-25(immunoglobulin lambda variable 3–25)和延伸因子1-alpha 1 (elongation factor 1-alpha 1),它们可能表明COVID-19疾病两个阶段的进展。
多项研究表明,尿液样本中检测到的蛋白质成分可以真实反映人体健康状况的变化。大部分尿蛋白来自穿过肾小球滤过屏障的血浆成分,以及来自肾脏和泌尿道的游离蛋白。因此,在不存在主泌尿疾病时,尿液的蛋白组成指示了一般健康状况。研究中发现了许多蛋白质的变化,揭示了感染初期免疫抑制和COVID-19患者紧密连接受损的情况。在感染后期也检测到一定程度的免疫激活。这些结果将为理解患者的临床症状提供重要的分子基础,并将阐明感染的两个阶段如何发生。课题组的研究数据表明,应更加注意感染初期发作的失调。该研究的局限性在于该数据集是相关的而不是纵向的。然而在人类感染过程中,COVID-19的这些异常特征将指导人们进一步了解COVID-19的发病机理,助力机理研究和临床治疗。
参考文献:
Immune suppression in the early stage of COVID-19 disease, Catherine C. L. Wong et al. Nature Communications volume 11, 5859 (2020)
由SARS-CoV-2病毒感染引起的新冠肺炎(COVID-19)已成为全球性的大流行病,行之有效的治疗干预措施对疫情的控制至关重要。然而到目前为止,新冠病毒感染后的发病机制尚未明确。
近日,北京大学医学部精准医疗多组学研究中心主任黄超兰团队,与中国科学院院士高福团队开展协同研究,发现早期的新冠感染患者存在着显著的免疫抑制,并首次提出COVID-19的发病机制或存在“两阶段”模式:第一阶段涉及免疫系统抑制、紧密连接受损以及大规模的代谢紊乱;第二阶段涉及部分免疫应答激活,可能进一步导致细胞因子风暴和器官损伤的发生。相关研究成果以“Immune suppression in the early stage of COVID-19 disease”为题于11月17日线上发表在Nature Communications期刊上。

图1. 新冠病毒感染的“两阶段”机制
研究者对来自健康志愿者,COVID-19患者和非COVID-19肺炎患者的尿液样本开展了基于DIA-PASEF方法的定量蛋白质组学分析。结果显示,与健康志愿者和非COVID-19肺炎患者相比,共有1986个蛋白在COVID-19患者体内发生显著变化,其中下调蛋白比上调蛋白的总数多出十倍,大量参与免疫应答和紧密连接形成的蛋白均呈现下调状态。
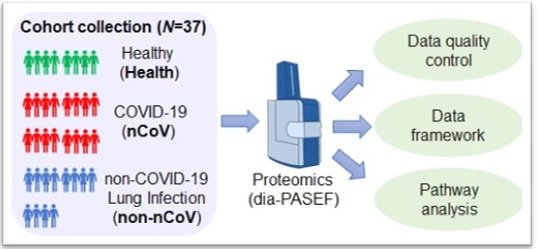
图2. 基于DIA-PASEF方法的定量蛋白质组学分析流程
为深入探索新冠肺炎的疾病进展机制,研究者将COVID-19患者划分为轻中症组和重症组。进一步的研究结果表明,免疫应答在疾病进展早期呈现抑制状态,在疾病进展晚期则表现出一定程度的上调。值得关注的是,与当前研究一致,近期陆续发表的多篇文章均报道COVID-19的临床症状主要呈现为免疫抑制,危重症患者有可能进一步出现“高炎症高细胞因子”症状1-3。
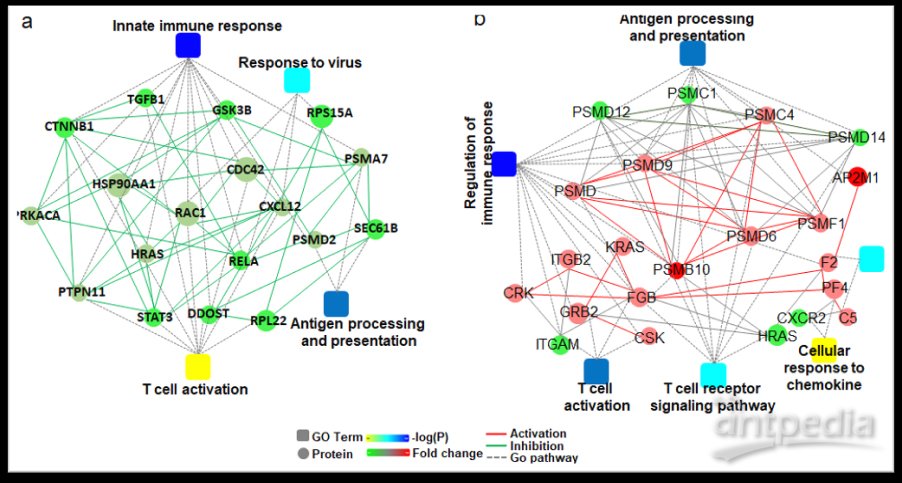
图3. 轻中症患者呈现免疫应答抑制(a)和重症患者呈现免疫应答上调(b)
此次,黄超兰主任领衔的多组学中心团队与高福院士领衔的多学科团队紧密合作,充分利用前沿的高通量DIA定量蛋白质组学技术,用高质量的数据为全面解读COVID-19患者的临床症状提供了可靠的重要分子基础和机制信息,有助于未来进一步探索优化的临床治疗方案设计。本研究示范了临床,前沿技术和基础学科的深度交叉融合。双方团队也在此课题基础上继续开展协同创新研究,持续为抗击新冠病毒做出多方面的贡献。
本次研究得到中国疾病预防控制中心(CDC)和首都医科大学附属北京佑安医院的大力支持。北京大学医学部精准医疗多组学研究中心主任黄超兰教授,中国科学院高福院士,北京大学医学部精准医疗多组学研究中心陈扬副研究员,中国疾病预防控制中心病毒病预防控制所谭文杰教授为本文的共同通讯作者;北京大学医学部精准医疗多组学研究中心田文敏博士、张楠同学,首都医科大学附属北京佑安医院院长金荣华教授,首都医科大学附属北京佑安医院科技处冯英梅处长,北京大学医学部精准医疗多组学研究中心王思媛博士为本文的共同一作。
原文链接:https://www.nature.com/articles/s41467-020-19706-9
相关文章:
1.Chen, L., et al. Confronting the controversy: interleukin-6 and the COVID-19 cytokine storm syndrome. Eur Respir J, 56(4):2003006 (2020).
2.Leisman, D., et al. Facing COVID-19 in the ICU: vascular dysfunction, thrombosis, and dysregulated inflammation. Intensive Care Med, 46(6):1105-1108 (2020).
3.Sinha, P., et al. Is a "Cytokine Storm" Relevant to COVID-19? JAMA Intern Med, 180(9):1152-1154 (2020).