2. 应激暴露增强了BLA-plPFC互反电路中的兴奋性信号
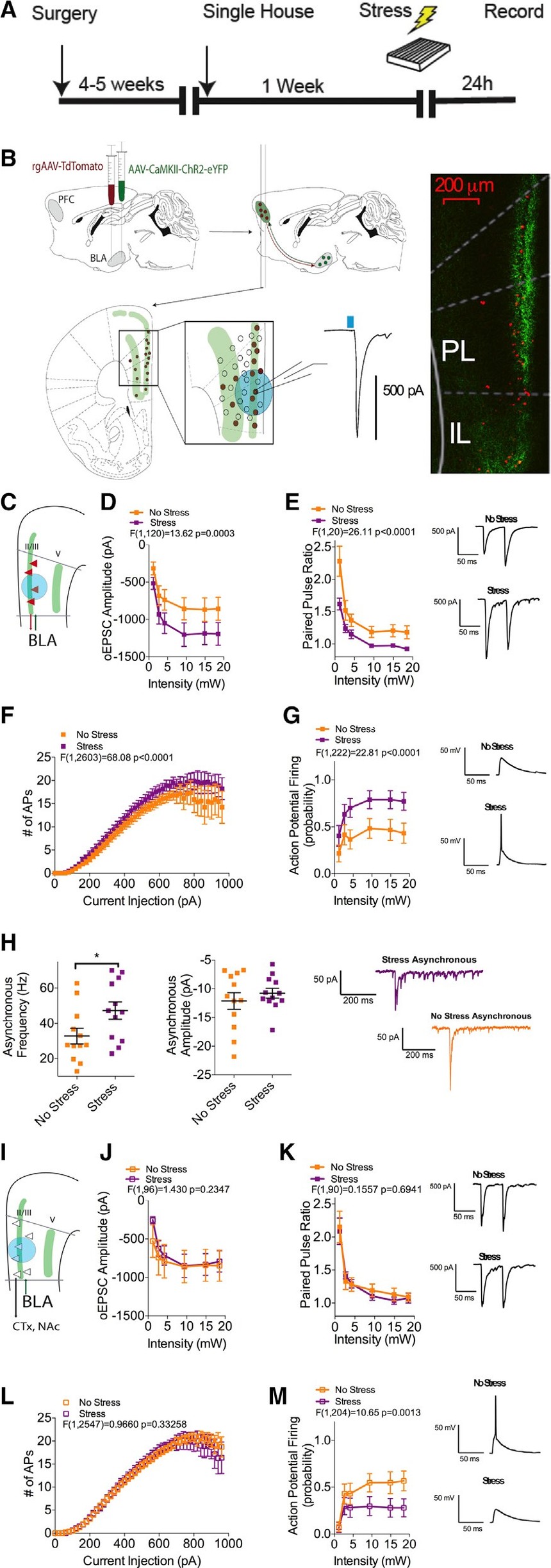
数据表明,增强的BLA-plPFC环路活性可能是环境压力转化为焦虑样行为的相关底物。为了研究在BLA-plPFC电路中受到压力诱导的突触适应性,使用了顺行chr2辅助投射靶向、逆行追踪方法和体外电生理学相结合的方法(图2A和2B)。将顺行性腺相关病毒aav5 - camki -ChR2- eyfp (ChR2)与逆行性AAV2-CAG-td-Tomato (rAAV)共注射入BLA后4 ~ 6周,处死小鼠进行体外电生理研究。
足底电击后24小时,研究人员观察到,rAAV+ L2/3 plPFC神经元中,BLA源性oEPSC振幅增加,配对脉冲比(PPR)下降(图2C-2E),应激后,在一个互反的BLA-plPFC-BLA子环路中,谷氨酸释放概率增加。这种增强的兴奋性驱动伴随着rAAV+ L2/3神经元突触驱动的动作电位放电概率的增加和这些神经元固有的兴奋性的少量但显著的增加(图2F和2G)。
研究人员还观察到,在L2/3rAAV+神经元上,光遗传诱导的异步EPSCs(o-aEPSCs)的频率增加,但幅度没有增加,证实了应激暴露后24小时BLA-plPFC突触的突触前释放概率增加(图2H)。相反,L2/3rAAV神经元的兴奋性输入(图2J)、PPR(图2K)或躯体驱动AP放电(图2L)在应激后没有明显变化。在L2/3 rAAV中观察到的唯一变化是神经元光基因诱发的动作电位放电明显减少(图2M)。
3. 内源性大麻素信号广泛地抑制从BLA到plPFC的谷氨酸能输入
鉴于观察到的应激诱导的BLA-plPFC谷氨酸能传递的增加是由增强的突触前释放介导的,研究人员接下来试图确定这种效应的驱动机制。众所周知,逆行作用的ECBs,即anandamide(AEA)和2-AG,受到应激的调节,并调节PFC中的突触传递,这增加了这个神经调制系统中的功能损伤可能有助于应激暴露后BLA-plPFC突触突触前驱动增加的可能性。为了验证这一假设,研究人员首先证明了大麻素受体激动剂cp55,940在rAAV+和rAAV中强烈地抑制了血乳酸诱发的oEPSC振幅。L2/3plPFC神经元,表明BLA投射到plPFC受到大麻素受体的广泛调节(图3A、3B、3E和3F)。为了确定ECBs是否调节BLA-plPFC谷氨酸能传递,研究人员分析了去极化诱导的兴奋抑制(DSE),这是一种典型的2-AG介导的短期突触抑制,突触后短暂的去极化导致2-AG的产生,并通过与突触前CB1受体结合抑制谷氨酸的释放。研究人员发现,突触后10s去极化至+30 mV诱导的DSE在L2/3rAAV+和rAAV上均有表达。CB1反向激动剂利莫那班或DO34是2-AG生物合成限速酶(DAGL)的抑制剂(图3C和3G)。有趣的是,这两个化合物单独诱导了PPR的显著降低,表明2-AG-CB1信号可以紧张性地抑制BLA-plPFC突触的谷氨酸释放(图3D和3H)。为了确保利莫那班对PPR的影响是由于阻断紧张性ECB信号而不是其反向激动剂特性,研究人员用中性CB1拮抗剂NESS0327(Ness)重复了这一实验。Ness和利莫那班都阻断DSE,降低PPR,并导致更大的oEPSC振幅,进一步支持ECB对BLA-plPFC谷氨酸能突触的紧张性控制。鉴于强直的ECB信号通常被归因于AEA,而不是2-AG(Kim和Alger,2010),研究人员通过证明利莫那班和DO34都增加了o-aEPSCs的频率,但没有增加幅度,从而增强了研究人员的PPR实验,证实了这些突触上的强直的2-AG-CB1信号(图3I-3K)。这些数据为BLAplPFC突触广泛表达的多模态强直相2-AG介导的突触前神经递质释放的调节提供了证据。为了检查ECB信号在plPFC中的输入特异性,研究人员在检查MDT向plPFC的投射时进行了相同的关键实验。众所周知,MDT具有低CB1的表达,因此,研究人员几乎没有观察到CP55,940诱导的oEPSC幅度的抑制和没有DSE,这表明ECB调节plPFC中的兴奋性传递具有电路水平的特异性。

4. 应激破坏了对BLA-plPFC互易谷氨酸能回路的2-AG抑制