Real Time PCR(qPCR),即实时荧光定量核酸扩增检测系统,是一种利用荧光染剂检测每次PCR循环后产物总量的方法技术,是常规PCR的衍生反应。主要是通过荧光信号的变化实时监测PCR扩增反应中每一个循环扩增产物量的变化,通过ct值和标准曲线的关系对起始模板进行定量分析。因其具有灵敏、特异、精确以及使用简便等优点,现已发展成为分子生物学研究中的重要工具。
首先先定义几个术语先以确保澄清事实。
 基本概念
基本概念
1.1 实时定量PCR的简写
建议实时定量PCR (quantitative real-time PCR) 应当简写为qPCR,反转录PCR (reverse transcription–qPCR) 应当简写为RT-qPCR。用RT-PCR简写表示qPCR可以引起混乱,并且与传统RT-PCR的平常应用不符。
1.2 内参基因
内参基因应当指的是参照基因(reference genes),而不是管家基因(housekeeping genes)。
1.3 TaqMan探针
TaqMan探针应指的是水解探针(hydrolysis probes)。
1.4 FRET probe
FRET probe (fluorescence resonance energy transfer probe, 荧光共振能量转移探针)指的是一种机制,基于2个荧光基团的电子激发状态之间的相互作用的基础上的发光/淬火。LightCycler型探针指的是双杂交探针(dual hybridization probes) 。
1.5 定量 quantification
牛津英语词典只列出了定量(quantification),非定量(non-quantification),因quantification是恰当的。
1.6 Cq
现在文献中使用的阈值循环(threshold cycle, Ct),交点(crossing point, Cp)和分支点(take-off point, TOP) 与PCR反应周期中的术语不一致。这些术语指的实际上在实时仪器是相同的值,只是不同仪器厂家为了竞争给自己产品的特定定义,不具有准确性和清晰性。根据实时定量PCR的标记语言的数据标准(www.rdml.org),建议同一使用定量循环(quantification cycle, Cq)这个术语。
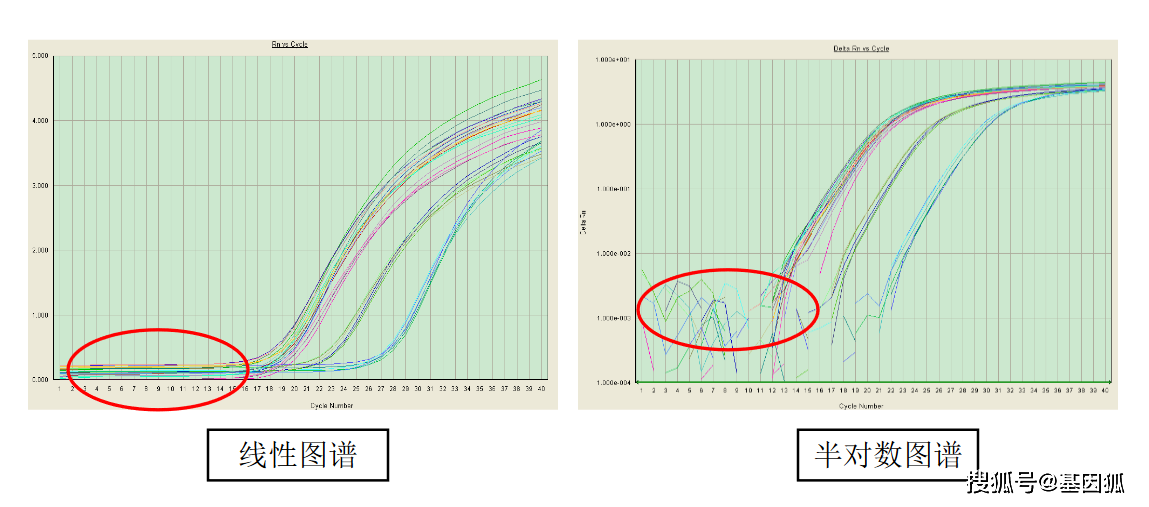
1.7 基线(baseline)
一般默认为3~15个循环的信号值就是基线(baseline),是由测量的偶然误差引起的。
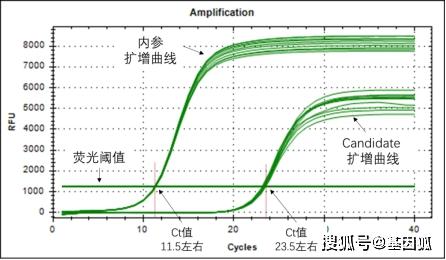
 基线
基线
1.8 阈值(threshold)
指在扩增曲线的指数增长区域内的适当位置上设定的荧光检出界限,一般是基线的标准偏差的 10 倍。
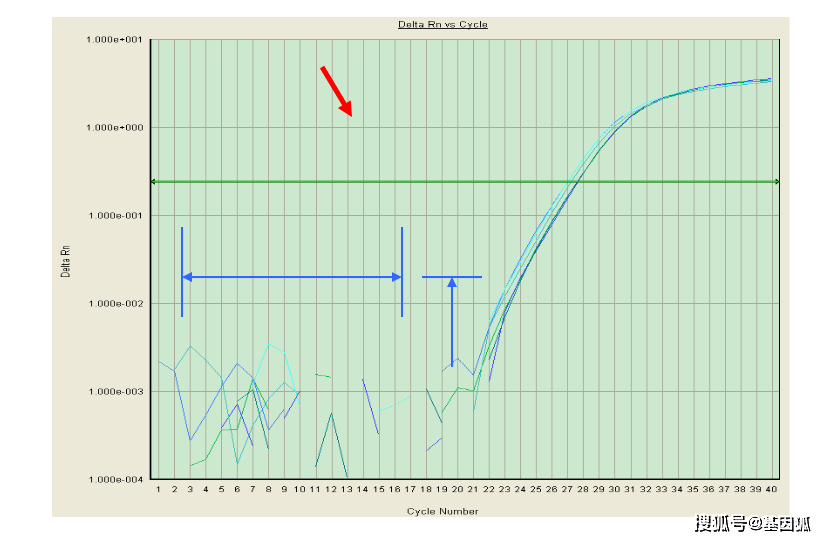 阈值
阈值
1.重复性很差
造成qPCR实验重复性差的原因有以下几点:
① 移液枪不准,加样不准确
这种情况下,我们可以更换性能更好的移液枪,扩大反应体积,将模板做高倍稀释,以大体积加入反应体系中
② 定量PCR仪在不同位置温度不一样
这个需要定期校准定量PCR仪
③ qPCR预混液未混合均匀
使用前应充分混匀qPCR预混液
注:重复性较为理想的扩增曲线STD<0.2
这个可能的原因有以下几点:
① 非特异性扩增
可以根据设计原则设计新的引物,可通过梯度 PCR 对引物退火温度进行优化
② 出现引物二聚体,引物为非特异性引物
引物设计不合理导致的引物二聚体在熔解曲线内峰值一般位于75℃左右,如该峰显著请按照以下方面进行优化:
(A)优化扩增条件,可设置梯度Tm,摸索最佳的Tm值
(B)引物浓度太高,适当降低引物浓度
(C)可通过琼脂糖凝胶电泳确认引物二聚体
③ 模板有基因组污染
重新制备cDNA模板即可
① PCR产物太长
PCR产物不宜太长,一般100-50bp即可
② cDNA模板降解
重新制备模板,重复实验
③ 扩增效率极低
优化反应条件,尝试三步法扩增程序,或者重新设计引物
④ 反应体系中存在PCR反应抑制剂
加大模板稀释倍数或者重新制备模板重复实验
⑤ cDNA模板浓度低
减少稀释度重复实验
内参基因Ct值正常,说明试剂及操作步骤无误。目的基因Ct值出现较晚,可能原因为:
① 目的基因表达量偏低--重新富集RNA
② 目的基因引物扩增效率低:
将模板进行梯度稀释,以确定引物的扩增效率
降低退火温度
重新设计引物
1)反应体系引起的扩增曲线不光滑---扩增效率偏差(过高或过低)
A. 扩增效率过高
出现非特异扩增或引物二聚体:反应体系内模板浓度太高以及模板核酸质量较差可能导致出现抑制PCR反应的现象。在绝对定量时表现扩增效率大于110%。
解决方案:
① 去除模板浓度最高的反应孔并重新分析标准曲线。如果效率重新回到110%以下,则分析良好;
② 对目的基因做标准曲线,一般用克隆该基因的质粒做梯度稀释,或用PCR 产物做梯度稀释,然后做定量扩增,通过曲线评估反应效率。绝对定量有效的扩增效率在90%-110%;
③ 重新纯化模板,去除模板中存在的潜在抑制物。切记应延长干燥时间,以去除乙醇沉淀过程中的乙醇,或采用另外的纯化柱加入洗涤液将离液盐从硅胶纯化物中去除。
B. 扩增效率过低
主要表现在试剂浓度不适(主要是引物、镁离子和Taq DNA聚合酶),尤其是在多重实验中,引物对Tm差异超过5°C 以及热循环条件不合适的情况下,试管中各种同源物质的竞争作用可造成反应效率低下。绝对定量表现:扩增效率<90%。
解决方案:对上述因素逐一排除后进行调整优化实验体系。
C. 个别扩增曲线异常
如个别扩增曲线突然骤降:反应管内留有气泡,由于温度升高后气泡破裂,使仪器检测到的荧光值突然降低所致。
解决方案:进行扩增反应之前要仔细检查反应管内是否有气泡残留。
2)仪器设置不当引起的曲线异常
基线设置不当,如扩增曲线断裂或下滑(基线的终点值大于Ct 值)。减小基线终点(Ct 值- 4),重新分析数据;
A.基线范围和阈值设置不当
基线范围和阈值都是人为设定的参数。二者一般由仪器自动默认为合适值。在对同一程序中的多种试剂盒或化学剂进行评估时,经常出现阈值设置不当造成不同组别数据的扩增曲线差异:软件自动选择的阈值更适合平台更高的曲线,这将导致数据组中的Ct值出现偏差,因为其最佳阈值比此值更低。因此,需对每个数据组进行独立研究,这样才能根据具体情形选择最佳阈值;
B.Rox 添加不当
表现为扩增曲线呈锯齿状且不连续,需校正参比染料。
① 加样误差
加大模板稀释倍数,提高加样体积
② 标准品降解
重新制备标准品,重复实验
③ 模板浓度太高
增加模板稀释倍数
A.相关系数(R2):>0.98,越接近1,结果可信度越高。R>0.99 或R2>0.98;
B.标准曲线斜率:-3— -3.5,100%扩增效率对应的斜率是-3.32;
C. PCR 扩增效率(E):90%-110%,越接近1,越理想。其对应的斜率为-3.58 至-3.10。效率= 10(-1/斜率)-1;
D.检测灵敏度确认:35Cycles 内可得到好的定量结果,如果采用SYBR 检测方法,30cycles 内无非特异性产物扩增;
E. NO template control (NTC)确认:35cycles 内无引物二聚体产生;
F. 重复性:STD<0.2。