等温多自配引发扩增(IMSA)即isothermal multiple self-matching-initiatedamplification,是对目前核酸分子检测技术手段的改进和补充,具有简单、快速、高灵敏性高特异性的优势。IMSA最大特点就是,在等温核酸扩增过程中会产生多倍数的能自我配对继而引发循环扩增的特殊核苷酸结构。这种结构的大量产生富集,使得随后循环扩增引发几率明显增加,继而使得扩增效率提高,最终使得检测灵敏度提升。就理论上而言,IMSA的灵敏度应该要高于LAMP的灵敏度。在结果判定上,同LAMP技术一样,IMSA能够通过观察副产物焦磷酸镁白色沉淀、于扩增前或后加入显色剂观察颜色变化等简单措施进行判定。
在引物设计上,IMSA与LAMP类似都利用了混合式引物的设计思路。所谓混合式引物,是指一条引物由目的基因同一条链的两段序列组成,其前段碱基顺序与靶位链的序列反向互补,后段则与靶位链序列同向。因此,混合式引物的扩增子(amplicon)3’端序列可与中间某段序列互补配对,故又称为自我配对结构(self-matchingstructure)。IMSA引物组成,如附图1所示。一共有三对引物,分别是一对外引物DsF/DsR,一对内引物FIT/RIT和一对茎引物SteF/SteR,其中外引物和内引物均是混合式引物。六条引物特异性地识别靶基因的七个位点,分别是F3、F2、F1、T、R1、R2和R3(附图1所示)。DsF由F1c和F3序列组成(F1c为F1的反向互补序列,下同),DsR由R1c和R3序列组成,FIT由Tc和F2组成,RIT由T和R2组成,SteF即R1c序列,而SteR即F1c序列。
IMSA扩增借助于链置换酶的催化作用,如需建立对RNA模板的扩增,还需利用AMV逆转录酶建立逆转录IMSA即RT-IMSA。IMSA的反应缓冲液可利用国产等温扩增缓冲液(广州迪澳公司等生产),其成分主要有dNTPs、甜菜碱、MgSO4和10×Bst 酶缓冲液等。添加IMSA六条引物后,通过反应条件优化(如温度、引物比例、酶的用量等),可建立最优化IMSA反应体系。最优化反应条件是:体系总体积为25μL,其中,4μL RNA模板、12.5μL 2×RM、1.0μL Bst 2.0 DNA聚合酶(8U/μL)、0.4μL AMV逆转录酶(10U/μL),对应基因的6条引物各1μL(引物浓度:DsF、DsR均为5μM,FIT、RIT均为20μM,SteF、SteR均为40μM)。反应条件63°C,时间1h。
IMSA扩增原理可分为两个阶段:一是原始自我配对结构(self-matchingstructure,SMS)的生成;二是基于SMS的自我循环扩增(cyclingamplification)。附图2所示为原始SMS的生成阶段(以其中一条靶位链的扩增做演示,另一条互补靶位链扩增类似)。首先,引物DsF中F3段、FIT中F2段和SteF分别识别靶位链上的F3c、F2c和R1位点,而后在Bst链置换酶的作用下引物不断延伸。当DsF延伸至FIT时,链置换酶会将FIT的延伸产物置换出来;FIT同样也会置换出SteF的延伸产物,但该产物对后续扩增无意义故不考虑。双链结构的DsF延伸产物会在甜菜碱作用变性成单链。然后,DsR和RIT分别识别DsF延伸产物的R3c和R2c位点,同样也分别识别FIT延伸产物的R3c和R2c位点。最后,在酶的置换作用下,可生成四条原始的自我配对的结构(SMS-1至SMS-4)。这四种原始SMS,因其3’端序列均与其内部序列互补配对故能自我配对形成闭合环状的DNA结构。
附图3(A-D)所示为基于原始SMS的循环扩增阶段。每条SMS在完成自我配对后均可在酶作用下延伸形成C环样(C-clamplike)结构。同时,在引物和酶的协同作用下,四种SMS可独立地激活循环扩增。附图3(A)、(B)、(C)和(D)分别为SMS-1、SMS-2、SMS-3和SMS-4的循环扩增示意附图。此阶段,IMSA产物主要是长双链C环样结构。
在产物检测上,同LAMP技术一样,IMSA能够通过对扩增产物进行琼脂糖凝胶电泳、观察副产物焦磷酸镁白色沉淀、于扩增前或后加入显色剂观察颜色变化等简单措施进行判定。主要有:(1)琼脂糖凝胶电泳法;(2)目测副产物焦磷酸镁沉淀法;(3)颜色判定法(借助于SYBRGreen、钙黄绿素、羟基萘酚蓝等染料);(4)实时浊度法(依赖Loopamp实时浊度仪);(5)实时荧光法(借助荧光采集仪器)。
IMSA是基于LAMP扩增原理和巢式PCR引物设计理念建立起来的新型等温扩增技术。IMSA与LAMP对比起来存在很大的相似性,尤其在产物检测或结果判定上二者是一样的。但是,IMSA跟LAMP还是存有明显差异性,主要体现在引物设计和扩增原理上。在引物设计上,IMSA跟LAMP有三点不同:(1)IMSA是六条引物识别七个位点,而LAMP六条引物识别的是八个位点;(2)IMSA的外引物是混合式引物,引入了茎引物的序列,而LAMP的外引物无此设计;(3)IMSA的内引物上游的5’端序列与下游的5’端序列是互补配对的,而LAMP的内引物无此设计。正是因为有上述引物设计差异,IMSA明显会产生比LAMP多的能自我配对的结构(这种结构在LAMP中称为茎环结构)。在扩增原理上,IMSA跟LAMP比同样存在三点不同:(1)IMSA的原始SMS生成阶段,能产生四条大小不等的SMS,而LAMP的初始阶段只能生成一条SMS即茎环结构;(2)在IMSA反应中,内外引物在整个扩增过程都发挥着作用,而LAMP的外引物只在初始阶段起富集模板作用;(3)IMSA反应中六条引物组合最佳比例经验证为DsF/R:F/RIT:SteF/R=1:4:8而LAMP的最佳比例为F3/B3:FIP/BIP:LoopF/LoopB=1:8:4。在应用上IMSA和LAMP具备同样的优点:(1)特异性强;(2)灵敏度高,而且IMSA在对某些靶位检测时会表现比LAMP更高灵敏度的优势;(3)扩增效率高;(4)结果易判读;(5)可摆脱仪器,适合现场检测;(6)检测时间短。
IMSA技术是本研究自行发明的新型等温扩增技术。IMSA不仅拥有LAMP检测技术类似的应用优点,在引物设计和扩增原理上还具有其独有的特点,使得其具备比LAMP更高检测灵敏度的潜力。该技术一定程度上能打破日本LAMPZL在我国的应用限制,使其更好地服务于我国的传染病防控、食品安全检测和环境物种保护等各个领域。目前,IMSA技术已经申报国家ZL,ZL申请号为201310370202.2,相信该技术的出现能为现有检测技术注入新的血液。
【附图及说明】
附图1IMSA引物组成及其位点
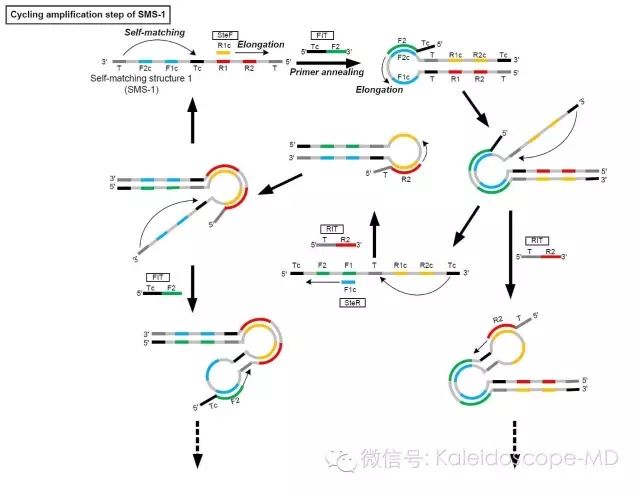
附图3(A)
IMSA反应中基于SMS-1结构的循环扩增示意图。FIT识别SMS-1自我配对延伸后形成C环样结构上的F2c位点,不断延伸并打开双链。SMS-1延伸结构的3’端又可进行自我配对,不断延伸至FIT时可将FIT的延伸产物置换出来,生成新的自我配对结构。新的SMS同样完成自我配对后在RIT引物作用下经过延伸、解链、配对、再延伸和再置换的过程后可生成原始SMS-1。而原始SMS-1延伸产物在RIT和FIT引物协同作用下不断延伸。依次循环以上过程,可形成基于原始SMS-1衍生的长链C环样结构。
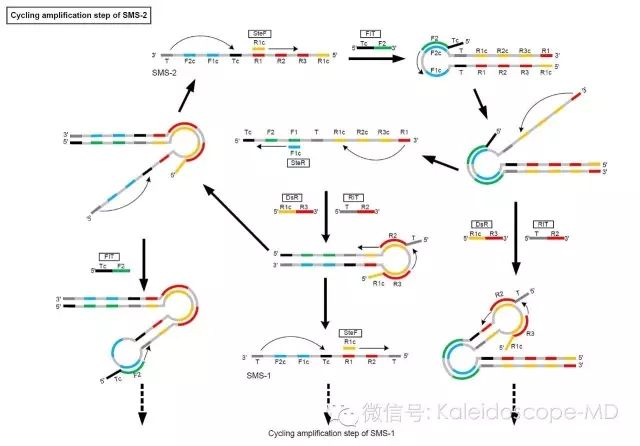
附图3(B)IMSA反应中基于SMS-2结构的循环扩增示意图。FIT识别SMS-2自我配对延伸后形成C环样结构上的F2c位点,不断延伸并打开双链。SMS-2延伸结构的3’端又可进行自我配对,不断延伸至FIT时可将FIT的延伸产物置换出来,生成新的自我配对结构。新的SMS同样完成自我配对后在DsR和RIT引物作用下经过延伸、置换、解链、配对、再延伸和再置换的过程后可生成原始SMS-1和SMS-2。而原始SMS-2延伸产物在DsR和RIT引物协同作用下不断延伸。依次循环以上过程,可形成基于原始SMS-2衍生的长链C环样结构。
附图3(C)
IMSA反应中基于SMS-3结构的循环扩增示意图。FIT和DsF分别识别SMS-3自我配对延伸后形成C环样结构上的F2c和F3c位点,不断延伸并打开双链,同时FIT延伸产物被置换形成新的SMS。SMS-3延伸产物的3’端又可进行自我配对,不断延伸至DsF时可将FIT的延伸产物置换出来,生成新的SMS。两个新的SMS同样完成自我配对后,经过延伸、置换、解链、配对、再延伸和再置换的过程后可生成原始SMS-1和SMS-3。依次循环以上过程,可形成基于原始SMS-3衍生的长链C环样结构。
附图3(D) IMSA反应中基于SMS-4结构的循环扩增示意图。FIT和DsF分别识别SMS-3自我配对延伸后形成C环样结构上的F2c和F3c位点。经过延伸、置换、解链、配对、再延伸、再置换和再解链的过程后可生成原始SMS-1至SMS-4。依次循环以上过程,可形成基于原始SMS-4衍生的长链C环样结构。