5.血糖、乳酸
血糖(Glu)升高是重症患者常见的病理现象。多年来,诸多的基础和临床研究得到几乎一致的认识,就是高血糖是危重患者的独立死亡危险因素之一。
乳酸(Lac)是体内糖代谢的中间产物。在某些病理情况下(如呼吸衰竭或循环衰竭时),可引起组织缺氧,由于缺氧可引起体内乳酸升高。
诊疗方案中的描述:重症患者组织氧合指标乳酸进行性升高;
常用仪器:生化分析仪、(重症可使用)血气分析仪
全自动化程度:不能批量上样,手动放置样本
样本及用量:静脉血浆、动脉全血
实验室开展要求:中心检验室、重症监护室
开展难度:★★★☆☆(有难度)
人们可以通过合理或严格血糖控制,显著降低多种疾病并发症的发生率和病死率。
另外,人体内葡萄糖代谢过程中,如糖酵解速度增加,剧烈运动、脱水时,也可引起体内乳酸升高。体内乳酸升高可引起乳酸中毒。检查血乳酸水平,可提示潜在疾病的严重程度。
新冠肺炎患者临床研究数据:《柳叶刀》线上1月29日发表的99例患者研究中[7],血糖平均7.4mmol/L(正常参考区间3.9-6.1 mmol/L),51例(52%)患者血糖升高,仅1例患者血糖降低。
6.降钙素原
降钙素原(PCT)是全身性细菌感染及脓毒症的诊断标志物,并可用于辅助鉴别细菌感染和病毒感染。
诊疗方案中的描述:多数患者降钙素原正常;
常用仪器:化学发光分析仪
全自动化程度:高、批量进样
样本及用量:静脉血清/血浆
实验室开展要求:中心检验室、急诊检验室
开展难度:★★☆☆☆(较容易)
当人体受到细菌感染时,细菌被免疫细胞分解所产生的脂多糖会刺激机体产生白介素、肿瘤坏死因子等细胞因子,继而促进体内脂肪细胞大量分泌PCT;当人体受到病毒感染时,机体受到病毒刺激产生干扰素(INF-γ),而INF-γ的产生则会抑制PCT的生成。可以利用细菌感染后降钙素原(PCT)升高的特点,将一部分细菌性肺炎患者早期鉴别出来进行对症治疗。
新冠肺炎患者临床研究数据:《柳叶刀》于1月24日发表的对41例患者研究[6]中,多数患者入院时血清降钙素原水平正常,四名ICU患者发生继发感染,其中三名降钙素原大于0.5ng/ml。《柳叶刀》线上1月29日发表的99例患者研究[7]中,其中4例(4%)脓毒性休克;6例患者(6%)降钙素原高于正常范围。
三、病情恶化指标应警惕指标
除前述根据病情应监测的项目外,还有以下指标变化应警惕病情变化:
1.细胞因子
细胞因子(Cytokine, Ck)由免疫细胞(如单核、巨噬细胞、T细胞、B细胞、NK细胞等)和某些非免疫细胞(内皮细胞、表皮细胞、纤维母细胞等)经刺激而合成、分泌的一类具有广泛生物学活性的小分子蛋白质。
诊疗方案中的描述:重型、危重型患者常有炎症因子升高;有条件者可行细胞因子检测;
常用仪器:流式细胞仪
全自动化程度:低,操作复杂
样本:血清
实验室开展要求:免疫学实验室(尚未在临床诊断上广泛开展,多为科研实验)
开展难度:★★★★☆(较难)
细胞因子一般通过结合相应受体调节细胞生长、分化和效应,调控免疫应答。
细胞因子可被分为白细胞介素(如IL-2、IL-3、IL-4、IL-5、IL-6、IL-9、IL-10、IL-12、IL-13、IL-14等)、干扰素(如IFN-γ)、肿瘤坏死因子超家族(如TNF-β)、集落刺激因子(如GM-CSF)、趋化因子、生长因子等。细胞因子的检测是基础免疫研究的有效手段,在临床疾病诊断、病程观察、疗效判断及细胞因子治疗监测方面有重要价值。
新冠肺炎患者临床研究数据:《柳叶刀》于1月24日发表的对41例患者研究[6]中,对比了NCP(新冠肺炎)患者中的ICU患者(n=13),非ICU患者(n=28),以及健康人(n=4)的细胞因子浓度,各类细胞因子在ICU组升高明显高于非ICU组,并且都高于健康对照组。
2.白细胞介素-6
白介素6(IL-6)是一种细胞因子,在人体急性炎症反应链中处于中心地位,诱导产生CRP和PCT等多种主要炎症因子。
诊疗方案中的描述:重型、危重型患者常有炎症因子升高;有条件者可行细胞因子检测。对于双肺广泛病变者及重型患者,且实验室检测IL-6水平升高者,可试用托珠单抗治疗。
常用仪器:化学发光分析仪
全自动化程度:高
样本:血清
实验室开展要求:中心检验室
开展难度:★★☆☆☆(较容易)
由于IL-6在炎症介质网络中的重要作用,血液中的IL-6浓度水平在多种临床疾病的病理过程早期均会出现明显升高,这些疾病主要包括细菌感染、新生儿败血症、脓毒血症、呼吸系统衰竭等。在多种细胞因子中临床意义最显著,可用常规方法在临床广泛开展。
新冠肺炎患者临床研究数据:《柳叶刀》1月29日发表的99例患者研究[7]中,有超过半数(52%)的患者IL-6升高。一些重症的患者体内产生了严重的细胞因子风暴,其中体内IL-6甚至达到了413.6pg/mL[8]。
3.淋巴细胞亚群
外周血淋巴细胞根据生物学功能和细胞表面抗原表达分为3个群:T淋巴细胞(CD3+)、B淋巴细胞(CD19+)和NK淋巴细胞。
诊疗方案中的描述:以下指标变化应警惕病情变化:外周血淋巴细胞计数进行性降低;淋巴细胞中B淋巴细胞明显降低,CD4及CD8 T细胞不断下降;
常用仪器:流式细胞仪
全自动化程度:低,操作复杂
样本:静脉全血
实验室开展要求:免疫学实验室(尚未在临床诊断上广泛开展,多为科研实验)
开展难度:★★★★☆(较难)
T细胞表面可表达多种分化抗原(CD)分子,如CD45、CD3、CD4、CD8、CD5等,这些膜分子对T细胞的检测、T细胞对抗原的特异性识别和应答,以及T细胞与其他免疫细胞之间的相互作用等都有着不同的生物学作用。T细胞参与细胞免疫反应,B细胞参与体液免疫反应。
淋巴细胞亚群分析是检测细胞免疫和体液免疫功能的重要指标,其总体反应机体当前的免疫功能、状态和平衡水平,并可辅助诊断某些免疫缺陷性疾病、变态反应性疾病,分析发病机制,观察疗效及监测预后。
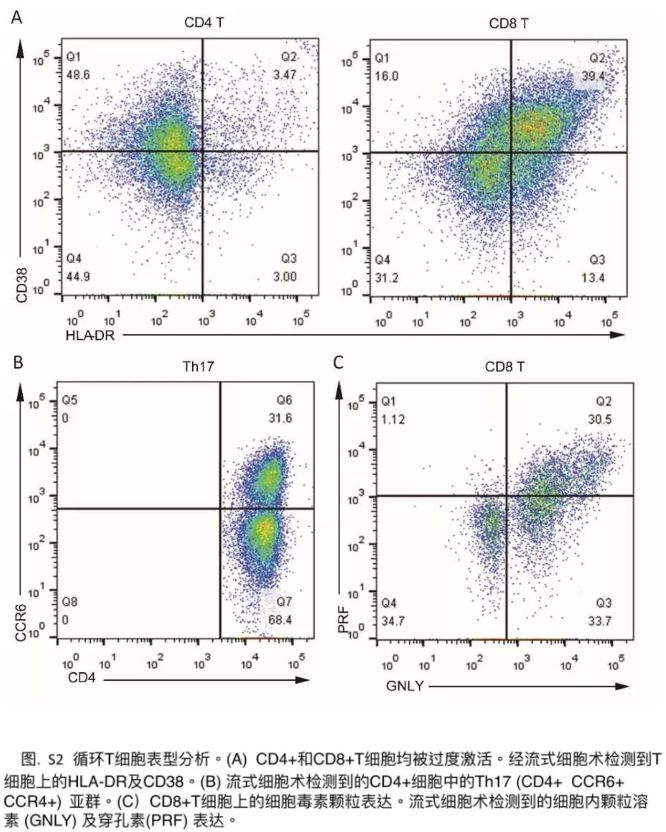
新冠肺炎患者临床研究数据:《柳叶刀》2月17日发表首例对新冠肺炎死亡患者病理解剖的分析报告[9]中,外周血流式细胞术分析发现,外周血CD4+和CD8+细胞的数量大大减少,而它们的状态却被过度激活。CD4+T细胞中具有高度促炎效应的CCR4+ CCR6+ Th17细胞增加。此外,发现 CD8+T细胞有高浓度的细胞毒性颗粒,其中31.6%的细胞为穿孔素阳性,64.2%细胞为颗粒溶素阳性,30.5%细胞为颗粒溶素和穿孔素双阳性(附录p3)。我们的结果表明,以Th17的增加和CD8+T细胞的高细胞毒性为表现的T细胞过度活化,能够部分地解释该患者的严重免疫损伤。
四、临床确诊指标
1.病毒核酸检测
所有生物除朊病毒外都含有核酸,核酸包括脱氧核糖核酸(DNA)和核糖核酸(RNA),新型冠状病毒是一种RNA病毒,通过鉴定病毒中的保守RNA序列可以将其与其他病原体进行区分。
诊疗方案中的描述:病原学确诊证据之一:采用RT-PCR或/和NGS方法在鼻咽拭子、痰和其他下呼吸递分泌物、血液、粪便等标本中可检测出新型冠状病毒核酸。检测下呼吸道标本(痰或气道抽取物)更加准确。标本采集后尽快送检。
常用仪器:核酸检测分析系统
全自动化程度:低,操作复杂、步骤多、耗时长
样本:咽拭子、痰液、呼吸道分泌物
检测时间:1个工作日
实验室开展要求:核酸检测实验室
开展难度:★★★★☆(较难)
检测新型冠状病毒特异序列的方法最常见的是荧光定量PCR(聚合酶链式反应)。因PCR反应模板仅为DNA,因此在进行PCR反应前,应将新型冠状病毒核酸(RNA)逆转录为DNA。在PCR反应体系中,包含一对特异性引物以及一个Taqman探针,该探针为一段特异性寡核苷酸序列,两端分别标记了报告荧光基团和淬灭荧光基团。探针完整时,报告基团发射的荧光信号被淬灭基团吸收;如反应体系存在靶序列,PCR反应时探针与模板结合,DNA聚合酶沿模板利用酶的外切酶活性将探针酶切降解,报告基团与淬灭基团分离,发出荧光。每扩增一条DNA链,就有一个荧光分子产生。
荧光定量PCR仪能够监测出荧光到达预先设定阈值的循环数(Ct值)与病毒核酸浓度有关,病毒核酸浓度越高,Ct值越小。不同生产企业的产品会依据自身产品的性能确定本产品的阳性判断值。
新冠肺炎患者临床研究数据:中国医学科学院院长王辰院士2月5日接受央视采访时曾表示,“这个病有个特点,并不是所有患病者都能检测出核酸阳性。对于真是这个病的病人,也不过只有30%-50%的阳性率。”
2.病毒基因测序
病原宏基因组测序(mNGS)是目前临床上针对病原最常用的基因测序方法,是一种基于二代测序技术的无需培养、无偏好性的病原检测技术,可一次性完成细菌、真菌、病毒和寄生虫等多种病原体检测。
诊疗方案中的描述:病原学确诊证据之一:病毒基因测序,与已知的新型冠状病毒高度同源;
常用仪器:测序仪
全自动化程度:低,需先进行核酸提取
样本:血液、痰液、肺泡灌洗液、组织液、拭子等
检测时间:1周内
实验室开展要求:临床基因扩增实验室
开展难度:★★★★★(高难度)
此次疫情中,病原宏基因组测序 (mNGS)利用其技术优势,在五天内就鉴定并分析出新型冠状病毒的基因组,而2003年SARS的鉴定耗时5月余、2013年H7N9的鉴定耗时1月余。因此,病原宏基因组测序 (mNGS)为本次疫情感染病原体的进一步确认以及防控争取了时间,也为后续的临床诊断、治疗和药物研发指明了方向[10]。
新冠肺炎患者临床研究数据:2020年1月10日,上海市公共卫生临床中心和公共卫生学院与华中科技大学武汉市中心医院、武汉市疾病预防控制中心、国家传染病预防控制所、中国疾病预防控制中心和澳大利亚悉尼大学合作,公开了2019冠状病毒基因组。
经数据分析,2019-nCoV与2003年爆发的SARS病毒基因组序列相似度为80%,与2017年2月从国内的蝙蝠中采集到的Bat SARS-like coronavirus isolate bat-SL-CoVZC45基因组序列相似性最高,相似度为88%。对2019-nCoV病毒株的基因组变异分析为追溯病毒来源、追踪病毒株变异路径、防控新型冠状病毒引发的疫情、治疗病毒性肺炎提供重要的数据基础与决策支持。
3.病毒抗体检测
IgM、IgG是机体对于病毒免疫应答的关键组成部分,临床上血清IgM、IgG抗体检测是病毒感染非常必要的、常规的实验室检查手段,比如乙肝病毒、丙肝病毒等,都是通过检测病毒刺激机体后产生的血清抗体来辅助诊断。
诊疗方案中的描述:血清学检查:新型冠状病毒特异性IgM抗体多在发病3-5天后开始出现阳性,IgG抗体滴度恢复期较急性期有4倍及以上增高。血清学确诊证据:
常用仪器:无需仪器,或免疫分析仪
全自动化程度:低
样本:静脉全血、血清
检测时间:操作简便,15分钟可完成检测
实验室开展要求:一般门诊检验室
开展难度:★☆☆☆☆(非常容易)
一般来说,最早产生的抗体是IgM,在机体受病原刺激一周左右出现,IgM持续时间较短。而后产生IgM的B细胞进入淋巴结,在生发中心接受辅助性T细胞和抗原提呈细胞的刺激,进一步成熟分化为浆细胞,大量产生IgG,IgG持续时间较长。因此,往往IgM抗体阳性表示近期感染,IgG抗体阳性表示感染时间较长或既往感染。
针对新冠病毒的特异性抗体检测,可用胶体金或化学发光法测病毒IgM及IgG,可在患者感染第7天或发病第3天就检测出来,对于进一步的确诊会很有帮助。
通过这些检测指标的分类介绍,是否更好的了解每项检查的意义了呢?从这些指标也可以看出患者初期就诊首先进行常规检查,结合合并并发症的相关检查、临床症状和其他辅助检测(如CT)手段及流行病学调查等,可以进行初步诊断;然后对疑似患者进行确诊检查;对危重症患者动态监测,观察病情变化。
【参考文献】
1. 《新型冠状病毒肺炎诊疗方案(试行第七版)》
2. 《新型冠状病毒肺炎重型、危重型病例诊疗方案(试行第二版)》
3. Guan W, Ni Z, Hu Y, et al. Clinical characteristics of 2019 novel coronavirus infection china. MedRxiv preprint, 2020,2,6.
4. Wang D, Hu B, Hu C, et al. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus–Infected Pneumonia in Wuhan, China. JAMA, Online February 7, 2020.
5. 新型冠状病毒肺炎相关静脉血栓栓塞症防治建议(试行). 中华医学杂志, 2020,100(00) : E007-E007.
6. Huang C, Wang Y, Li X,et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020 Jan 24.
7. Chen N, Zhou M, Dong X, et al.Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet 2020, 395: 507–13.
8. Fang Y, Zhang H, Xu Y, et al. CT Manifestations of Two Cases of 2019 Novel Coronavirus(2019-nCoV) Pneumonia. 2020 Feb 7.
9. Xu Z, Shi L, Wang Y, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet. 2020 Feb 17.
10. 陶悦、傅启华、莫茜等. 病原宏基因组测序在新型冠状病毒检测中的应用与挑战. 中华检验医学杂志, 2020,43:网络预发表.