上一篇简单介绍了光片荧光显微镜的一些基本知识,光片显微镜的诞生大大拓展了生命科学的研究视野,但它也有一些需要克服的天生缺陷和技术难点。本期就让我们从这里开始,一步步追寻光片显微镜的发展足迹。

正如我们在上一期提到的那样,传统的光片是由高斯光束通过一个柱形透镜来实现的。 最初,只用一个照明物镜和一个成像物镜(图1),称为L-SPIM。这种光片最大的问题是照明不均匀,光强会沿着传播方向逐渐减弱。为了解决这个问题,有效视野只能选择相对均匀的照明范围,因此样品必须做至少四次90°旋转 (图1),成像速度很慢,而且还要再使用复杂的算法进行后处理,很容易产生伪迹。
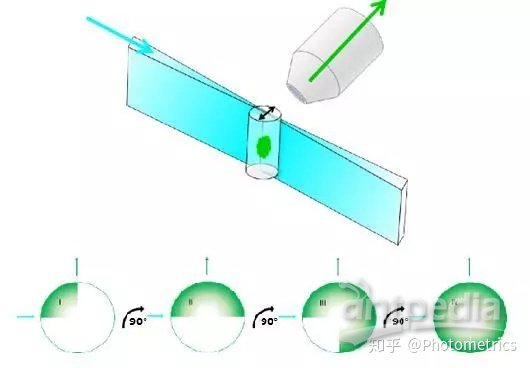
图1 L-SPIM:需要旋转至少四次才能完整成像
为了解决这个问题,科学家们做出了改进,使用两个相对的物镜进行双边照明,称为T-SPIM(图2)。T-SPIM扩大了有效视野,增加了成像速度。但深部的样品信号由于色散和散射特性,成像效果还是比较差。为了保证图像质量,仍需要将样品旋转180°。
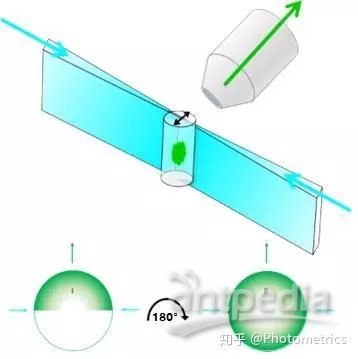
图2 T-SPIM双向照明:旋转180°就能完整成像
或者使用两个成像物镜同时进行双边成像(mSPIM,图3)。通过旋转样品,将多角度的图像进行融合,可以得到在 xyz 方向上一致的分辨率,z轴分辨率可以提高3倍。
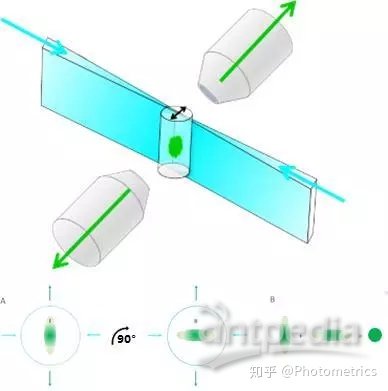
图3 mSPIM。双边照明和双边成像:对样品在0°和90°分别成像,融合之后产生各向相同的分辨率
目前市面上各种各样的T-SPIM主要是在光片数和位置上有所不同,目的都是为了获得更加清晰准确的图像。如何将两个光片进行完美的匹配是这种方法主要的技术难点。
早期的光片显微成像中还存在伪影问题(图4A, C)。这是指由于样品中含有光密度较高的结构如色素等阻挡了激发光,或包含具有微透镜特性的物质(如脂质)造成光的散射和照明不均匀而产生的一些暗线。解决这个问题的一种方法,是小角度高速旋转照明光片(图4B, D),使得部分在某个照明角度下的阴影,在另一个照明角度下显现出来。
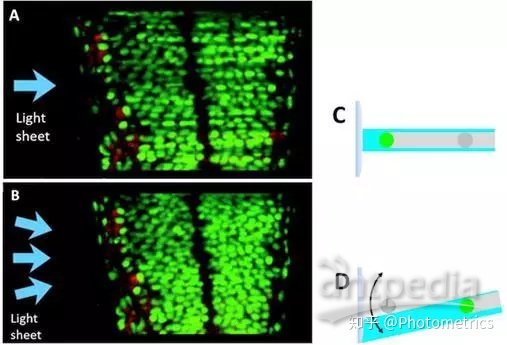
图4 图像伪影。A)斑马鱼胚胎受精后32小时光片成像。B) 光片旋转后A中样品成像。C)色素或更大的荧光结构挡住了照明光。D)光片旋转后改善了这种情况。(Huisken & Stainier, 2009)
另外一个解决办法是将组织透明化(图5)。一个多世纪以来,研究者们不断开发出各种有机和无机溶剂,将更大的样品透明化,从而能够更深入更详细地研究样品结构。
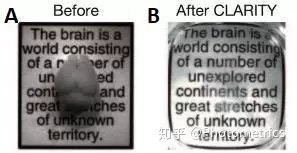
图5 组织透明化(CLARITY法)。A)小鼠大脑透明化前B)透明化后(Chung et al.,2013)
另外,样品的固定也是光片显微镜的一大难题。要进行活体成像,样品必须固定在光学透明的培养基中,才不会影响成像,并且样品要方便进行旋转。从单个细胞到整个器官,样品固定方法五花八门,取决于研究人员的创造力和具体样品的需求 (图6A-D),这里我们就不进行详细讨论了。

图6 样品安装示例。A)固定在琼脂糖内的斑马鱼胚胎。B)挂钩固定的组织/器官。C)聚四氟乙烯管中的细胞球。D)附着在玻片上的细胞。(Reynaud et al. , 2015)
现在我们使用的大部分光片系统都不使用柱形透镜,而是通过激发光扫描得到的“虚拟”光片(图7),称为DLSM(Digital scanned light sheet microscopy)。和静止光片相比,扫描光片照明更加均匀。由于扫描速度很快,需要比静止光片更高的峰值激发功率(但和传统宽场显微镜以及共聚焦相比,仍然要小得多)。

图7 基于高斯光束扫描的L-SPIM光片
扫描光片和使用卷帘快门(rolling shutter)的 sCMOS 相机可以形成完美的配合。通过相机和扫描光束之间的同步,实现只有当前读取的行被激发光照射,杜绝了非成像区域的干扰信号,提高图像对比度和分辨率。Teledyne Photometrics sCMOS 相机内置的 Programmable Scan Mode (图8)就是专门为此而设计的。

图8 Programmable Scan Mode:同步相机曝光和扫描光片激发光
正如我们在上一期最后讲到的,高斯光束产生的光片厚度和长度之间是相互制约的,无法满足细胞水平以下的分辨率要求,因此不断追求极限的科学家们又将目光投向了贝塞尔光束 (图9)。贝塞尔光束理论上是非衍射光束,与高斯光束相比,它的截面直径小得多,一般< 1 µm,传播时截面轮廓和光强都保持不变;同时它还具有自愈特性,经过散射组织后,光束形状的失真很小。虽然事实上我们无法得到真正理想的贝塞尔光束,但是通过使用轴对称衍射光栅来聚焦高斯光束,或在远场中放置窄环形光圈,我们可以得到近似的贝塞尔-高斯光束,在一定的距离内几乎没有衍射。
2011和2012年,诺贝尔奖获得者 Eric Betzig 教授研究组的 Planchon 和高亮等首先尝试用贝塞尔光束扫描来产生光片(图10)。光片的尺寸在整个长度上不会发生显著变化,从而进一步提高了有效视野和分辨率。

图9 A)高斯光束B)贝塞尔光束。Power & Huisken (2017)

图10 基于贝塞尔光束扫描的L-SPIM光片
贝塞尔光束光片也存在一个问题,即当截面越小,也就是光片越薄的时候,旁瓣的能量也会越高,这样就会导致非焦平面的样品被激发,降低了分辨率,增大了光毒性。2014年,Eric Betzig研究组的陈壁彰、王凯等人又在Science杂志上发表了晶格光片显微镜(Lattice Light-Sheet Microscopy)技术。通过使用空间光调制器(SLM),让照明物镜发出的激发光形成并行排列的多束贝塞尔光束(图11),同时实现光束的倍增和激发。这种方法有几个显著的优势:
与结构光照明(SIM)相结合,显著降低旁瓣能量的同时维持较薄的光片厚度,进一步提高图像空间分辨率
能够在极低的峰值激发功率下快速成像,光毒性更小
同时照亮整片样品,增加了有效视野,大大加快了成像速度(可达200fps)
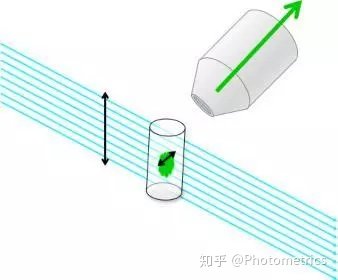
图11 并行贝塞尔光束
配合大视野的高速sCMOS相机(如Teledyne Photometrics 公司的Prime BSI,Iris15等),Lattice Light-Sheet 非常适用于对活细胞进行4D成像。高速,高分辨率,低光毒性,意味着我们可以在更长的时间内记录细胞内的生理活动。
除了晶格光片显微镜之外,光片显微镜家族还有许多其他的兄弟姐妹,我们将在下一期中继续为大家介绍,请持续追番~
References
Chen,B.C. et al. Lattice light-sheet microscopy: imaging molecules to embryos athigh spatiotemporal resolution. Science346, 1257998 (2014).
Chung, K., Wallace et al. Structural and molecular interrogation of intact biological systems. Nature. May 16;497(7449):332-7 (2013)
Fahrbach FO, Voigt FF, Schmid B, Helmchen F, and Huisken J, Rapid 3D light-sheet microscopy with a tuneable lens. Optics ExpressVol. 21(18): 21010-21026 (2013)
Huisken, J. & Stainier, D. Y. R. Selective plane illumination microscopy techniques in developmental biology. Development.Jun;136(12):1963-75 (2009)
Planchon,T.A. et al. Rapid three-dimensional isotropic imaging of living cells using Bessel beam plane illumination. Naturemethods 8, 417-423 (2011).
Power, R. M. & Huisken, J. A guide to light-sheet fluorescence microscopy for multiscale imaging. Nature Methods. Mar 31;14(4):360-73 (2017)
Reynaud EG, Peychl J et al. Guide to light-sheet microscopy for adventurous biologists. Nat Methods. Jan;12(1):30-4 (2015)
Voie A. H., Burns, D. H., Spelman, F. A. Orthogonal- plane fluorescence optical sectioning: three-dimensional imaging of macroscopic biological specimens. J Microsc. Jun;170(Pt 3):229-36 (1993)