急性髓系白血病(acutemyeloidleukemia,AML)是一类在临床及细胞遗传学上均具有高度异质性、克隆性的造血干细胞疾病,通常是由多种致病因素共同作用的结果,细胞和分子遗传学异常是其致病基础。BCR-ABL融合基因是由t(9;22)(q34;q11)产生,常见于超过90%的慢性髓性白血病(chronicmyeloidleukemia,CML)患者,20%~35%的成人急性B淋巴细胞白血病(B-ALL)及2%~5%的儿童B-ALL患者亦可检测到该融合基因,称为Ph+B-ALL。AML伴BCR-ABL较少见,占AML患者的0.5%~3.0%〔1〕。近期我们确诊1例BCR-ABL阳性AML,现报告如下并复习相关文献,以期对该类疾病有更深刻的认识,从而提高治疗效果。
1病例资料
患者,男,64岁,因“头晕、恶心1个月余”住院。患者2020年2月出现头晕、恶心,当时无呕吐、头痛、发热、腹痛、腹泻等不适,渐影响日常生活。于3月初就诊当地医院,查血常规示白细胞正常,血红蛋白及血小板减少(WBC4×109/L,Hb54g/L,PLT15×109/L),外周血分类可见幼稚细胞(约占23%),给予输注成分血纠正贫血治疗后头晕缓解,为进一步诊治3月7日就诊我院。病程中,无发热、出血、骨关节疼痛表现,精神、食欲差,睡眠尚可,大小便正常,体重减轻5kg。患者2010年发现血压升高,最高为140~150/60~70mmHg(1mmHg=0.133kPa),不规律口服降压药物,近期血压波动在130/60mmHg,未服药。诊断2型糖尿病10余年,口服降糖药物治疗,未规律监测血糖。既往有阑尾切除术史,个人史、家族史均无特殊。入院体检:体温36℃,血压117/57mmHg,贫血貌,胸骨无压痛,浅表淋巴结未触及肿大,心肺体检阴性,腹软,无压痛、反跳痛,肝、脾肋下未触及,双下肢无水肿。
2实验室检查方法、结果及诊疗经过
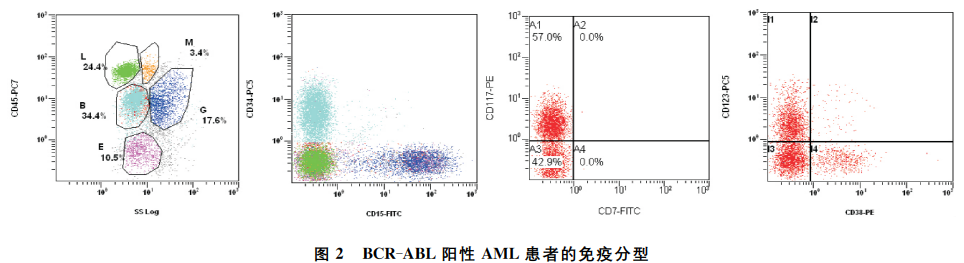
常规骨髓细胞形态学:以髂后上棘为穿刺点进行骨髓穿刺术,取适量骨髓液涂片,同时取少量外周血进行涂片,进行瑞特-吉姆萨染色,光学显微镜下计数骨髓片中有核细胞200个,外周血100个有核细胞,分析细胞形态及比例。免疫分型:骨髓液2ml置于EDTA抗凝管,应用直接免疫荧光法检测相关分化抗原,抗体及流式细胞仪均为美国BD公司产品。以CD45为纵坐标,侧向角散射(SSC)为横坐标绘制散点图,通过CD45/SSC设门法圈出白血病细胞群并分析该群细胞中各相关抗原的阳性率。·197·核型分析:骨髓液2ml置于肝素抗凝管,细胞培养24或48h,收获前60min加秋水仙碱处理、低渗、固定、制片、染色,莱卡GSL120显微镜下分析20个分裂相。融合基因:骨髓液2ml置于EDTA抗凝管,提取有核细胞总RNA并逆转录为cDNA,应用43种融合基因筛查试剂盒和荧光定量PCR仪(ABI7500)和Taqman探针法进行检测。34种基因突变筛查采用高通量测序法(NGS)。入院后查血常规示:白细胞5.18×109/L,血红蛋白74g/L,血小板19×109/L,嗜碱性粒细胞0.05×109/L;肝肾功能、凝血试验、心电图、胸部CT大致正常;腹部彩超示肝、脾未见明显异常。骨髓像示增生明显活跃,粒单系占64.5%,原粒单+幼单占23.5%,该类细胞外形规则,细胞质量少或中等,呈灰蓝色,少数细胞质内可见紫红色颗粒,核圆形、肾形,染色质细致,核仁清晰,中粒以下阶段部分细胞可见类巨变、空泡、核固缩;红系占14.5%,淋巴系占11.0%,巨核130个,血小板少见(图1a);细胞化学染色:过氧化物酶染色(-)14%(+)15%(+++)71%(图1b);形态学诊断为AML-M4。免疫分型:异常髓系幼稚细胞表型占34.4%,表达CD34,CD117,CD123,CD38;部分细胞表达HLA-DR,CD13,CD33;而CD7,CD19,CD16,CD15,CD11b,CD56,CD64,CD14,CD36,cyCD79a,cyMPO,cyCD3均为阴性(图2)。43种融合基因筛查示BCR/ABL阳性,余均为阴性。BCR-ABL(P190)/ABL=29.223raw%。34种基因突变筛查:TP53突变型(73.44%)。染色体核型未见异常。根据骨髓形态学、免疫分型及基因检测诊断为BCR-ABL阳性AML(P190,e1a2)。a:瑞特-吉姆萨染色;b:过氧化物酶染色。图1BCR-ABL阳性AML患者骨髓形态结果图2BCR-ABL阳性AML患者的免疫分型 明确诊断后诱导化疗方案给予地西他滨(10mg第1~14天)联合CIG(伊达比星5mg第1~4天,阿糖胞苷40mg第1~14天,重组人粒细胞刺激因子400μg/d),期间血红蛋白浓度60g/L左右,间隔1周需输注悬浮红细胞4U;血小板数波动在(10~20)×109/L,约3~5d输注单采血小板1U;白细胞数波动在(1~2)×109/L,中性粒细胞绝对值为(0.1~1)×109/L,故未联合酪氨酸激酶抑制剂(tyrosinekinaseinhibitors,TKI)治疗,骨髓抑制期合并肠道菌群失调,但是无发热。化疗结束后第16天复查骨髓像:增生活跃,原粒单+幼单占17%,未缓解,出院休息1周。4月21再次入院时血常规:白细胞1.35×109/L,血红蛋白39g/L,血小板2×109/L。予以成分血输注治疗同时口服氟马替尼片">甲磺酸氟马替尼片(400mg/d)1周后,给予地西他滨(25mg第1~5天)联合DA方案(柔红霉素60mg第1~3天,阿糖胞苷150mg第1~7天)再诱导化疗,化疗结束后氟马替尼调整为600mg/d,骨髓抑制期合并肛周感染,给予支持、对症治疗后好转。5月18日复查骨髓像:增生低下,原粒单占1%;MRD未见异常幼稚细胞群;BCR-ABL(P190)/ABL=14.3raw%。5月26日出院时血常规:白细胞1.14×109/L,血红蛋白63g/L,血小板48×109/L。出院后患者就诊北京某医院,建议异基因外周血造血干细胞移植,因患者年纪大、无全相合供者等原因,患者及家属不考虑移植。开始口服BCL-2抑制剂(Venetoclax20mg/d起,逐步加量为100mg/d)维持治疗,定期复查血常规,白细胞数、血红蛋白浓度、血小板数逐渐恢复正常。6月1日行BCR-ABL1激酶区耐药突变检测(NGS法),E255G、E373G突变阳性,将氟马替尼改为达沙替尼(20mg2次/d)治疗。7月7日我院门诊复查血常规:白细胞3.59×109/L,血红蛋白102.8g/L,血小板241×109/L;骨髓像:增生活跃,粒单系占47%,原粒单为0;外周血未见原始幼稚细胞;MRD未见异常幼稚细胞群;BCR-ABL(P190)/ABL=0.585raw%。7月26日联合地西他滨(10mg第1~7天)治疗。随访至2020年8月底,患者一般情况好,无特殊症状体征。

3讨论
并文献复习2016年修订的世界卫生组织(WHO)髓系肿瘤和急性白血病分类标准中,将BCR-ABL阳性的AML列为一种伴有重现性遗传学异常的AML暂定型〔2〕,它属于原发AML,这类患者没有任何证据提示曾罹患CML,并且无诊断重现性遗传学异常AML常见的改变如CEBPA、NPM1、inv(16)等〔3〕。BCR-ABL阳性AML发病率低、相关报道少见,国内更是以个案报道为主〔4〕。临床工作中,究竟是BCR-ABL阳性AML还是CML急变期,有时鉴别困难。2016年Neuendorff等〔5〕分析了自1975年以来发表的126例初发BCR-ABL阳性AML的患者,是目前样本量最大的回顾性分析,其中仅16.7%(21/126)合并脾大。Soupir等〔6〕分析了16例初发BCR-ABL阳性AML患者,25%(4/16)合并脾大,同期对照组CML急变期65%(13/20)的患者合并脾大(P=0.02)。此外,CML急变期的患者外周血中嗜碱性粒细胞(中位值2.5%,平均值4.6%)明显高于BCR-ABL阳性AML(中位值0,平均值0.6%)(P=0.004)。我们报道的病例既往无血液学异常病史、脾不大、外周血嗜碱性粒细胞不高,按照WHO诊断标准及相关文献,可确诊为BCR-ABL阳性AML,而非CML急变期。TKI可明显提高CML和Ph阳性ALL患者的缓解率,且已有报道提示其在提高BCR-ABL阳性AML患者缓解率方面有积极作用,但对于治疗的开始时间、剂量、维持时间、单药使用还是联合化疗等问题均缺乏大规模临床研究。本病例第1个疗程采用标准剂量传统药物化疗,未获得完全缓解。再诱导缓解化疗时在标准剂量化疗基础上联合TKI治疗,获得了血液学及分子生物学缓解。有研究表明该类疾病总体预后较差,应在首次缓解后尽早行异基因造血干细胞移植,但该患者年龄大、无全相合供者,不同意异基因造血干细胞移植,如何使疾病持续缓解成为难题。近年来,国内外诸多临床试验均表明靶向治疗在AML中取得了良好效果,其中包括选择性Bcl-2抑制剂Venetoclax,其在2016年4月11日获得美国FDA批准上市。Souers等〔7〕研究表明,Venetoclax能通过特异性地抑制Bcl-2蛋白,激活内源性线粒体凋亡通路,使肿瘤细胞快速凋亡。2019年Wei等〔8〕关于Venetoclax对不能耐受化疗的老年AML患者的多中心、单臂1/2期临床试验获得美国血液学年会(ASH)的最佳摘要,其研究结论为Veneto-clax联合低剂量阿糖胞苷治疗老年AML的中位完全缓解率为62%,相关病死率低(<30d病死率为3%),达到完全缓解所需的时间较短(中位时间为1个月)。本文中报道的患者,诱导缓解后应用TKI、Venetoclax联合低剂量地西他滨维持治疗,分子生物学达更深层次缓解,使疾病处于缓解状态达3个月余,为BCR-ABL阳性AML的治疗提供新思路。
参考文献略。