9102 药品杂质分析指导原则
本原则用于指导化学合成的原料药及其制剂的杂质分析,并供药品研究、生产、质量标准起草和修订参考。本原则不涵盖生物/生物技术制品、肽、寡聚核苷酸、放射性药品、发酵产品与其半合成产品、中药和来源于动植物的粗制品。
杂质是药品的关键质量属性,可影响产品的安全性和有效性。药品质量标准中的杂质系指在按照经国家药品监督管理部门依法审查批准的工艺和原辅料生产的药品中,由其生产工艺或原料带入的杂质,或在贮存过程中产生的杂质,不包括变更生产工艺或变更原辅料而产生的新杂质,也不包括掺入或污染的外来物质。若药品生产企业变更生产工艺或原辅料引入新的杂质,则需要对原质量标准进行修订,并依法向药品监督管理部门申报批准。药品中不得掺入其组分以外的物质或污染药品。对于假药和劣药,必要时应根据具体情况,采用合适的且经过验证的分析方法予以检测。
1. 杂质的分类
药品杂质通常分为:有机杂质、无机杂质、残留溶剂。有机杂质可在药品的生产或贮存中引入,也可由药物与辅料或包装结构的相互作用产生,这些杂质可能是已鉴定或者未鉴定的、挥发性的或非挥发性的,包括起始物、副产物、中间体、降解产物、试剂、配位体和催化剂;其中化学结构与活性成分类似或具渊源关系的有机杂质,通常称为有关物质。无机杂质可能来源于生产过程,如反应试剂、配位体、催化剂、元素杂质、无机盐和其他物质(例如:过滤介质,活性炭等),一般是已知和确定的。药品中的残留溶剂系指原料药或辅料的生产中,以及制剂制备过程中使用的,但在工艺操作过程中未能完全去除的有机溶剂,一般具有已知的毒性。
由于杂质的种类较多,所以,药品质量标准中检查项下杂质的项目名称,应根据国家药典委员会编写的《国家药品标准工作手册》的要求进行规范。如有机杂质的项目名称可参考下列原则选用。
(1)检查对象明确为某一物质时,以该杂质的化学名作为检查项目名称,如磷酸可待因中的“吗啡",氯贝丁酯中的“对氯酚”,盐酸苯海索中的“哌啶苯丙酮”,盐酸林可霉素中的“林可霉素B”和胰蛋白酶中的“糜蛋白酶"等。如果该杂质的化学名太长,又无通用的简称,可参考螺内酯项下的“巯基化合物”、肾上腺素中的“酮体”、盐酸地芬尼多中的“烯化合物”等,选用相宜的名称。在质量标准起草说明中应写明已明确杂质的结构式。
(2)检查对象不能明确为某一单一物质,而又仅知为某一类物质时,则其检查项目名称可采用“其他甾体”“其他生物碱”“其他氨基酸”“还原糖”“脂肪酸”“芳香第一胺”等。
(3)未知杂质,可根据杂质性质选用检查项目名称,如“杂质吸光度”“易氧化物”“易炭化物”“不挥发物”“挥发性杂质”等。
2. 质量标准中杂质检查项目的确定
新原料药和新制剂中的杂质,应按我国新药申报有关要求和ICH新原料药中的杂质(Q3A)和新制剂中的杂质(Q3B)指导原则进行研究,必要时对杂质和降解产物进行安全性评价。新药研制部门对在合成、纯化和贮存中实际存在的杂质和潜在的杂质,应釆用有效的分离分析方法进行检测。对于表观含量在表1鉴定阈值及以上的单个杂质和在鉴定阈值以下但具强烈生物作用的单个杂质或毒性杂质,予以定性或确证其结构。对在药品稳定性试验中出现的降解产物,也应按上述要求进行研究。新药质量标准中的杂质检查项目应包括经质量研究和稳定性考察检出的以及在批量生产中出现的杂质和降解产物,并需制定相应的检查限度。除降解产物和毒性杂质外,原料药中已控制的杂质,制剂中一般不再控制。原料药和制剂中的无机杂质,应根据其生产工艺、起始原料情况确定检查项目,但对于毒性无机杂质,应在质量标准中规定其检查项。药品杂质的报告、鉴定和确证阈值参照ICH新原料药中的杂质(Q3A)和新制剂中的杂质(Q3B)指导原则(表1)。若制定的阈值高于表1阈值,则需进行科学评估;若杂质的毒性很大,应制定更低阈值。
在仿制药的研制和生产中,如发现其杂质谱与其原研药不同或与已有法定质量标准规定不同,需增加新的杂质检查项目时,也应按上述方法进行研究,申报新的质量标准或对原质量标准进行修订,并报药品监督管理部门审批。
多组分药物中共存的异构体一般不作为杂质检查项目,必要时,在质量标准中规定其比例,以保证生产用与申报注册时的原料药一致性。但当共存物质具有毒性时,应作为毒性杂质进行检查。而在单一对映异构体药品中,可能共存的其他对映异构体和非对映异构体应作为杂质检查。
药品多晶型杂质,应参照本药典药品晶型研究及晶型质量控制指导原则(指导原则9015),确定检查项目。
具有遗传毒性的杂质(又称基因毒性杂质),应参照ICH评估和控制药品中DNA反应性(致突变)杂质以降低潜在致癌风险指导原则(M7)进行研究,并确定检查项目。
无机杂质参照ICH元素杂质指导原则(Q3D)进行研究,并确定检查项目。

a 取限度低者
报告阈值(reporting threshold):超出此阈值的杂质均应在检测报告中报告具体的检测数据。鉴定阈值(identifica tionthreshold):超出此阈值的杂质均应进行定性分析,确定其化学结构。确证阈值(qualifica tionthreshold):超出此阈值的杂质均应基于其生物安全性评估数据,确定控制限度。TDI:药品杂质的每日总摄入量(total daily intake)。
残留溶剂,应根据生产工艺中所用有机溶剂及其残留情况,参照本药典残留溶剂测定法(通则0861)和ICH残留溶剂指导原则(Q3C),确定检查项目。
3. 杂质检查分析方法
杂质检查应尽量采用现代分离分析手段,用于杂质检测和定量测定的分析方法须按照本药典分析方法验证指导原则(指导原则9101)和ICH指导原则(Q2)进行验证。尤为重要的是,应能证明分析方法具有检测杂质的专属性。
研究时,应采用几种不同的分离分析方法或不同检测条件以便比对结果,选择较佳的方法作为列入质量标准的检查方法。杂质检查分析方法的建立,应考虑普遍适用性,所用的仪器和实验材料应容易获得。对于特殊实验材料,应在质量标准中写明。在杂质分析的研究阶段,将可能存在的杂质、强制降解产物,分别或加入主成分中,配制供试溶液进行色谱分析,优化色谱条件,确定适用性要求,保证方法专属、灵敏。
杂质研究中,应进行杂质的分离纯化制备或合成制备,以供进行安全性和质量研究用。对确实无法获得的杂质,研制部门在药品质量研究资料和药品质量标准起草说明中应写明理由。
在采用现代色谱技术对杂质进行分离分析的情况下,对特定杂质中的已知杂质和毒性杂质,应使用杂质对照品进行定位;如无法获得杂质对照品时,可用相对保留值进行定位。杂质含量可按照色谱法等测定。
对于对映异构体杂质的检测多采用手性色谱法或其他立体选择性方法,应用最为广泛的是手性高效液相色谱法。对于对映异构体杂质检查方法的验证,立体选择性是实验考察的重点。当对映异构体杂质的出峰顺序在前,母体药品在后,则有利于两者的分离和提高检测灵敏度。由于手性色谱法不能直接反映手性药品的光学活性,需要与旋光度或比旋度测定相互补充,以有效控制手性药品的质量。对消旋体药物的质量标准,必要时亦可以设旋光度检查项目。
由于采用色谱法进行杂质限度检查时,受色谱参数设置值的影响较大,有关操作注意事项应在起草说明中写明,必要时,可在质量标准中予以规定。
4. 杂质的限度
药品质量标准对毒性杂质和毒性残留有机溶剂应严格规定限度。杂质限度的制订可参考本药典和ICH相关指导原则的要求,考虑如下因素:杂质及含一定限量杂质药品的毒理学和药效学研究数据,原料药的来源,给药途径,每日剂量,给药人群,治疗周期等。
原料药和制剂质量标准应包括如下。
(1)每种特定的已鉴定杂质。
(2)每种特定的未鉴定杂质。
(3)任何不超过鉴定阈值的非特定杂质。
(4)杂质总量(所有超过报告阈值的特定和非特定杂质或降解产物的总和)。
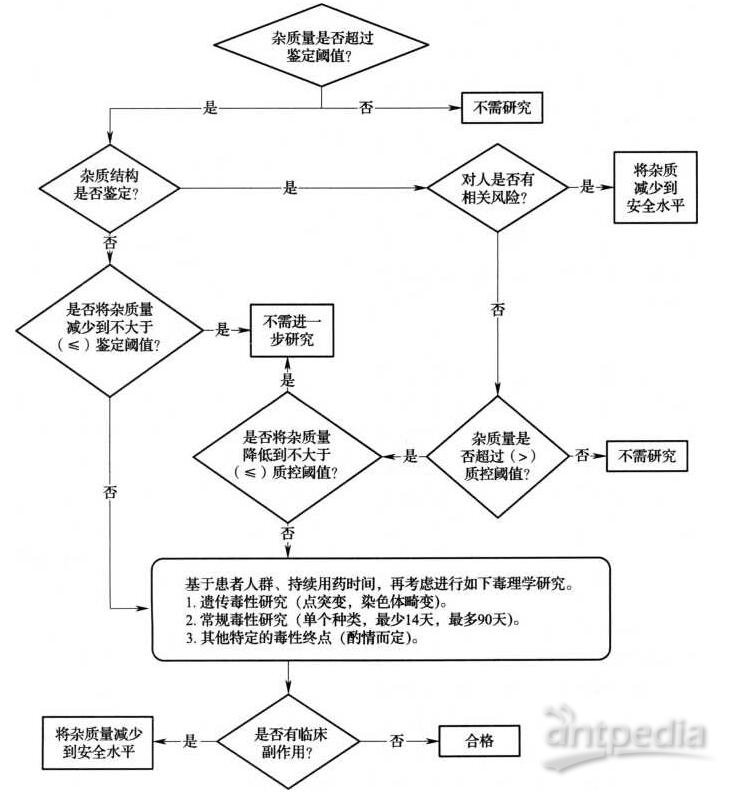
药品杂质鉴定与质控的决策树如下。