一例小脑及脑干可逆性后部脑病综合征合并静脉畸形伴出血病例分析
患者男,32岁,因头晕及右侧肢体麻木7d于2015年4月27日入住北京天坛医院神经内科。入院前7d,患者晨起突发头晕、头痛,以后枕部明显,伴恶心、呕吐、视物双影且模糊,于2015年4月21日就诊于当地医院,血压为253/160mmHg,即给予静脉滴注治疗(具体药名及剂量不详)后症状无好转;2015年4月22日,患者仍觉右侧肢体麻木,肌力无异常,于当地医院行头部CT检查,显示桥脑片状异常低密度影;2015年4月23日,当地医院头部MR扩散加权成像(DWI)示左侧枕叶皮质小斑片异常高信号(图1a),T2加权成像(T2WI)及液体衰减反转恢复序列(FLAIR)示桥脑、双侧小脑半球及左侧枕叶皮质下多发高信号,遂于当日转入北京天坛医院急诊科。急诊科测血压为180/113mmHg,体格检查无阳性发现;头部CT检查显示桥脑斑点状高密度影,边界清,双侧小脑半球密度不均,周围未见明显水肿(图1b)。
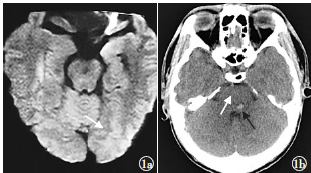
图1a为2015年4月23日外院MR扩散加权成像(DWI)(轴面),显示左侧枕叶皮质小斑片状异常高信号(箭头所示);1b为2015年4月23日天坛医院CT(轴面),显示桥脑斑点状高密度影(黑色箭头所示),边界清,双侧小脑半球密度不均(白色箭头所示);
当日,急诊头部MRI显示,双侧小脑及左侧枕叶血管性水肿,DWI未见明显异常,双侧小脑半球及左侧枕叶多发斑点状高信号,表观扩散系数(apparent diffusion coefficient,ADC)值升高(图1c~1f);桥脑病灶DWI及ADC低信号,暗化效应可能;T2WI及FLAIR显示双侧小脑半球可见斑点状高信号,桥脑病灶低信号,边缘清楚呈高信号环状表现;T1加权成像(T1WI)示桥脑及双侧小脑病灶信号稍低。T2WI、FLAIR、T1WI及DWI与当日外院头部MRI表现基本一致,磁敏感加权成像(SWI)显示桥脑病灶低信号,最大强度投影(MIP),示前方与异常静脉(中心引流静脉)相连(图1g),提示此处静脉有畸形的可能;此外,双侧小脑半球多发小点状低信号,为多发微出血灶。MR血管成像(MRA)提示,颅内大血管形态及走形均无异常,后循环椎动脉及基底动脉未见明显管腔狭窄征象。
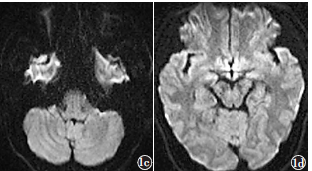
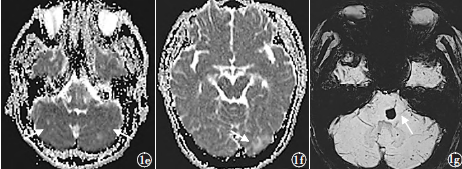
图1c为2015年4月23日天坛医院急诊MRDWI(轴面),显示双侧小脑半球无明显信号改变;1d为2015年4月23日天坛医院急诊MRDWI(轴面),显示左侧枕叶无明显异常高信号表现;1e为2015年4月23日天坛医院急诊MRI表观扩散系数(ADC)(轴面),显示双侧小脑半球多发斑点状高信号改变(箭头所示),ADC值升高;1f为2015年4月23日天坛医院急诊MRIADC(轴面),显示左侧枕叶小斑片状高信号改变(箭头所示),ADC值升高;1g为2015年4月23日天坛医院急诊MR磁敏感加权成像(SWI)(轴面),显示桥脑小片状低信号影,最大强度投影(MIP)图示前方与异常静脉(中心引流静脉)相连(箭头所示);
考虑脑梗死伴出血转化收入本院神经内科。患者自诉既往无高血压、糖尿病及心脏病史,有吸烟史10余年。入院时血压174/119mmHg,意识清楚,未见病理征。入院诊断:脑梗死伴出血转化;高血压3级,极高危;右侧肾动脉狭窄。经降血压治疗后,血压由180/113mmHg降至144/96mmHg。2015年4月29日凌晨,患者病情突然加重,上肢不能抬起,右下肢可平移活动但不能抵抗重力作上下运动。急行头部CT检查,发现桥脑出血灶周围可见小片状水肿密度影(图1h),与4月23日对比,桥脑病灶可见周围水肿密度影。嘱患者多喝水,增加静脉容量后病情较前好转。
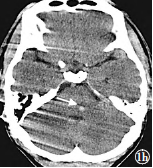
图1h为症状突然加重CT(轴面),显示桥脑出血灶周围可见小片状水肿影(箭头所示);
2015年4月30日至5月11日,患者血压平稳,均未超过140/90mmHg。5月7日复查头部MRI,显示DWI桥脑病灶高信号,ADC值降低,提示水分子扩散受限,而原双侧小脑病灶于ADC图上消失(图1i),桥脑病灶于FLAIR及T2WI上显示高信号改变,而双侧小脑、枕叶皮质及皮质下发病时多发斑片及斑点状T2WI、FLAIR及ADC图上原病灶处高信号消失。患者共治疗25d,2015年5月18日出院时无头痛、头晕,无恶心、呕吐,四肢肌力Ⅴ级,活动正常。2015年6月18日门诊复查头部CT,显示桥脑病灶呈小片状低密度改变,可能为出血灶吸收期;6月19日检查头部MRISWI,显示双侧小脑半球微出血灶仍存在,桥脑偏左为小片状低信号改变,较4月23日SWI显示的低信号病灶缩小,MIP图仍可见原畸形静脉走形处串珠样低信号改变,汇入前方静脉(图1j)。
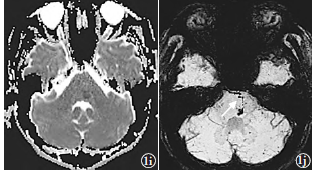
图1i为2015年5月7日MRIADC(轴面),显示原双侧小脑半球病灶消失;1j为2015年6月19日MRSWI(轴面),MIP图显示原畸形静脉走形处表现为串珠样低信号,汇入前方静脉(箭头所示)
讨论
1996年,Hinchey等观察到某些患者伴随高血压时,可出现一系列相似的神经损害症状,并出现可逆的、特征性的累及后部脑循环(主要是基底干和大脑后动脉)供应区域脑白质的影像学特点,提出了可逆性后部白质脑病综合征(reversible posterior leukoencephalopathy syndrome,RPLS)。随着对该综合征的不断了解及影像学技术的进步,发现相当一部分病灶并非仅脑白质受累,2000年Casey等提出了可逆性后部脑病综合征(posterior reversible encephalopathy syndrome,PRES)这一新的定义。其是一组由多种原因引起,以神经系统异常为主要表现的综合征,临床上以迅速进展的颅高压症状、癫痫发作、视觉障碍、意识障碍、精神异常为特征。
影像学上,PRES病变的典型部位主要位于大脑后部顶枕叶,也可累及额颞叶、小脑、脑干及基底节等不典型部位。PRES病灶MRI典型表现为,发生在双侧枕叶皮质及皮质下的血管性水肿,即DWI高信号及ADC值升高,这可与脑梗死时DWI扩散受限(DWI高信号,ADC值减低)相鉴别。但PRES病灶也可发展为脑梗死,造成不可逆损伤,如本例患者桥脑处病灶发生出血2周后复查,可见DWI扩散受限改变,其原因可能为血肿压迫脑组织造成不可逆的梗死病灶,也可能因病灶内血液黏稠造成DWI扩散受限,但患者已完全恢复,无新发症状,故考虑为病灶内血液黏稠造成DWI扩散受限。双侧小脑半球多发斑点斑片状的FLAIR高信号在DWI上并未显示,且FLAIR对于患者左侧枕叶皮质下水肿的显示较T2WI更为明显,故FLAIR对于病灶显示更具优势,与文献描述一致。
小脑及枕叶皮质的T2WI及FLAIR高信号的病灶,在2周后复查时消失,表明其具有可逆性,符合PRES的影像学特征。有研究认为,PRES的病灶并非总可逆,而是指存在可逆性,可逆性病灶可能见于严重高血压、产后子痫、尿毒症和经过免疫治疗的患者,而原因不明者的病情可能不会恢复,甚至可能进展恶化。Wagih等认为,年龄、血压、DWI扩散受限、FLAIR/DWI值及ADC值均不能预测PRES是否可逆。关于PRES的发病机制,存在不同假说,一种假说认为,脑血管自动调节能力的短暂丧失导致过度灌注;另一种假说认为,脑血管痉挛引起了缺血,但毛细血管内皮细胞激活/损伤导致的血-脑屏障结构和功能的破坏可能是血管性水肿发生的主要机制。
本例患者病变部位主要在后循环供血区(小脑、脑干及左侧枕叶),相对缺乏丰富的交感神经支配,脑血管自动调节能力也相对受限,在血压骤增时脑过度灌注,细胞内物质渗入到细胞间质而致血管性水肿。多数学者支持脑自动调节功能崩溃学说。本例患者虽未做DSA,但SWI对于静脉畸形的显示具有一定优势。本例经MRSWI检查,显示桥脑病灶左前方异常静脉影,2周后复查时,在原畸形静脉走形处可见串珠样低信号影,汇入前方静脉,进一步佐证第1次就诊时桥脑出血病灶合并了静脉畸形,故考虑为桥脑PRES病灶合并静脉畸形伴出血。静脉痉挛也可致PRES患者脑实质水肿,推测本例PRES桥脑出血病灶与静脉血压有间接关系。另双侧小脑可见多发微出血灶,而有文献指出微出血灶发生及多少与临床症状严重程度并无关联。
本例患者经降压治疗后出现症状加重情况,影像学表现为桥脑出血病灶周围水肿加重,经增加静脉容量治疗后病情好转,故考虑为低灌注导致病情波动加重,而低灌注与发病时高灌注的病理生理学机制可完全不同,但具有相似的临床症状及影像表现,故我们认为,PRES发病及进展机制复杂,多种病理生理改变可能并存或交替存在。PRES影像学表现的血管性水肿使该病具有一定的特征性,有文献表明,PRES也可出现细胞毒性水肿或血管性水肿与细胞毒性水中同时出现,使其影像表现更具多样性。此外,PRES的发病机制说法不一,更需与患者病史相结合,以进一步加深对该病的理解。