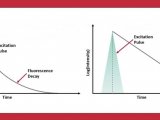
免疫荧光细胞化学染色
目前广泛使用的免疫荧光染色在细胞骨架研究中的应用也很常见。其主要原理为用标记有荧光的抗体(或抗原)对细胞或组织内相应的抗原(或抗体)进行定性,定位,定量检测,即先将已知的抗体(或抗原)标记上荧光素制成荧光标记物,然后再将这种荧光标记物作为探针检测细胞或组织内相应的抗原(或抗体)。
鉴于这样的原理,免疫组织化学染色有高度的特异性和灵敏性,可以在染色体、细胞器、细胞水平原位检测抗原分子。但非特异性染色也是实验中必须要考虑到的。
免疫荧光技术分为直接法和间接法。直接法是用已知的特异性抗原(或抗体)标记上荧光素制成探针直接与细胞中对应的抗体(或抗原)结合来进行检测。这种方法特异性强,但是一种荧光探针只能检测一种抗原或抗体,灵活性比较差,而且信号通常也比较弱。
而间接法就很好地解决了这些问题。间接法是先用特异性的抗原(或抗体)与细胞或组织中相应的抗体(或抗原)反应,然后再用标记有荧光素的此抗原的抗体与结合在细胞或组织上的抗原结合。现在间接法的使用更为普遍,除了使抗体和染料的选择范围更为广泛,更重要的是还能够通过一抗二抗这样的组合放大信号。
荧光蛋白
荧光蛋白能够自发发出荧光,由生命体自我复制表达,并能够通过设计达到自动标记靶蛋白的目的,是跟踪活细胞或组织甚至生命体的有效手段。荧光蛋白的受激发无种属特异性,产生荧光也不需要底物或辅助因子之类的,且与荧光蛋白融合表达的蛋白质在细胞内仍然可以发挥正常功能。
细胞骨架属于动态结构,在很多生命过程中都发挥着重要作用,上面提到的各种荧光标记方法主要适用于固定或经过透膜处理的细胞,不能很好地追踪活细胞的动态活动,荧光蛋白就解决了这个难题。
在细胞骨架研究中最为常用的荧光蛋白为GFP和RFP[11]。GFP分子量大约20kDa,其融合蛋白不影响目的蛋白的功能,且转染的细胞可以继续传代培养。GFP基因可以作为一种直观,简便和有效的报告基因。GFP是由一小段DNA序列所编码,易于操作和构建各种各样的融合体。将GFP与目的蛋白构建成融合蛋白基因,当融合蛋白在细胞中表达时,目的蛋白就有荧光标记了。荧光蛋白定位与另一个常用的技术-免疫组化相比有很多优点,免疫组化步骤繁琐,检测的是固定后的细胞。
GFP作为报告基因与目的基因融合后对目的基因的结构和功能无影响,对细胞无毒性,目的蛋白在细胞内仍然可以发挥正常的功能,细胞还可以继续传代培养,可对活细胞进行实时观察,这是荧光染色和免疫荧光无法做到的。

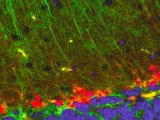
图 4[14] pEGFP-Lifeact和pEYFP-actin转染的鼠胚胎成纤维母细胞 (REF52wt)微丝形态。(A) EGFP-Lifeact ,(B) EYFP-actin 转染以及分别与Alexa647-phallodin标记共定位(C,D)。发现Phalloidin 标记和EGFP-Lifeact转染的细胞在微丝形态上高度一致,而EYFP-actin转染的细胞显示出更加明显的应力纤维。(E,F) Merged 图像 (Scale bar:25μm)。
我们可以直接构建微丝或微管的荧光蛋白,当然也可以构建其结合蛋白的荧光蛋白。但是,也有报道指出融合荧光蛋白对细胞伸展、迁移、粘附有副作用[12]。RiedlJ [13]提出的Lifeact则能排除这种副作用。Lifeact是将GFP与一个仅17个氨基酸的源自酵母的多肽(Lifeact)融合(间接地与细胞骨架蛋白连接),实验已经证实Lifeact标记的微丝形态与非转染类的phallodin标记的几乎一样,即对细胞影响很小。而EGFP-actin则会改变微丝的整体形态和动态行为。当然目前融合蛋白在细胞骨架研究中还是发挥着重要作用,只是当涉及到生物力学特别是力诱导细胞骨架重排的研究时Lifeact会更合适[14]。
细胞骨架的标记方法远不止上述这些,相关技术也在不断进步,新探针也在不断优化。Stefan W Hell今年就提出了一种远红外的荧光探针SiR,融合了光毒性小,光稳定性好,荧光明亮等优点,可以说是研究活细胞细胞骨架的完美探针,同时在STED成像中也有出色表现[15]。
参考文献
[11]Yoon, Y., et al. (2002). "Studying cytoskeletal dynamics in living cellsusing green fluorescent protein." Molecular Biotechnology 21(3): 241-250.
[12]FengZ, Ning Chen W, Vee Sin Lee P, Liao K, Chan V (2005) The influence of GFP-actinexpression on the adhesion dynamics of HepG2 cells on a model extracellularmatrix. Biomaterials 26: 5348–58.
[13]RiedlJ, Crevenna AH, Kessenbrock K, Yu JH, Neukirchen D, et al. (2008) Lifeact: aversatile marker to visualize F-actin. Nat Methods 5: 605–7.)
[14]Deibler, M., et al. (2011). "Actinfusion proteins alter the dynamics of mechanically induced cytoskeleton rearrangement."PLoS One 6(8): e22941.
[15]Lukinavicius, G., et al. (2014). "Fluorogenic probes forlive-cell imaging of the cytoskeleton." Nat Meth 11(7):731-733.
本文若需引用或转载,请联系我们,注明源自徕卡显微系统,并保留徕卡显微系统及原作者相关版权信息。