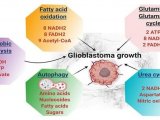
前言
无菌产品对于无菌防控的目的是为了控制产品对于微生物、微粒和热原的污染风险,从而确保产品的安全性。细胞治疗产品作为无菌产品的一种,因其生产固有的特点,自人体采集细胞后,需要通过全程无菌操作来进行产品的生产,无法通过终端灭菌等方法或技术进行控制。因此对整个生产过程中各要素的无菌保证要求有一定程度的挑战,以下这些无菌防控的理念和思考方向,可进行关注。
无菌防控管理可总结为无菌防控技术与在线管理的结合。
无菌防控技术
定义:指的是保持无菌物品、无菌区域、无菌产线及产品不被污染、防止微生物污染的一系列技术手段,包括可确保无菌保证状态的硬件、耗材及无菌操作技术。
属于技术层面,总结为:懂、防、测
识别风险点(懂) → 制定硬软件防控措施(防)→ 确定检测手段(测)
无菌在线管理
定义:指的是基于产品的无菌保证要求,在现有无菌技术的基础上制定的一系列确保无菌状态维持和有效运作的管理手段。
属于管理层面,总结为:行、补、管
有效执行(行) → 持续改进PDCA,如CAPA(补) → 系统闭关管理(管)
《药品生产质量管理规范》附录:细胞治疗产品(征求意见稿)中对于该产品的污染防控做出了明确的要求,其中第二章的第四节第四条指出:
【防止污染和交叉污染】鉴于供体材料的可变性及可能含有传染性疾病的病原体,且培养过程易导致污染,细胞治疗产品的生产全过程应当尤其关注防止微生物污染。
细胞操作及培养的特点
1、起始材料为生物活性物质,生产过程存在可变性
2、细胞操作及培养全过程是生物学过程也是无菌操作过程
3、培养过程所用的物料是污染微生物生长的良好培养物质
4、相对于微生物培养,细胞培养的周期长,对无菌要求非常高
5、依赖于设备性能、一次性无菌耗材
细胞污染的途径
对于无菌防控特别需要注意的是外源性的生物污染
现今多数细胞治疗产品生产过程会采用非密闭系统进行细胞操作及培养,这也是因为其操作的便捷性并基于其工艺的传统经典操作,如在B+A环境中,使用生物安全柜进行细胞培养等各项操作。
采用无菌工艺生产的无菌药品,其无菌保证水平取决于生产流程的整体设计及管理,建议注意以下三个模块。
一、无菌操作人员的管理及培训
与无菌管控相关的包含以下内容
1、人员健康
2、穿戴适宜的洁净工作服
3、正确的更衣和洗手
4、正确的洁净室操作行为
5、洁净区内的人数控制及活动区域限制
6、定期生物安全防护、无菌操作及意识培训
7、外来人员管理
举 例
GMP细胞治疗附录第三章人员的第九条中规定:
【人员安全防护培训】从事细胞治疗产品生产、质量保证、质量控制及其他相关人员(包括清洁、维修人员)应当经过生物安全防护的培训,尤其是经过预防经供体材料传播疾病方面的知识培训,以防止传染性疾病的病原体在物料、产品和人员之间传播以及对环境潜在的影响。
此条特别强调了从事细胞治疗产品生产并与产品可能接触的人员的安全防护培训要求,重点是防护经供体材料传播的疾病。由于供体材料来源于人体,因此可能携带的传染基本也是人源性的,对于操作人员来说具有较高风险。
二、无菌技术的充分性
这里的无菌技术指的是包含可确保无菌保证状态的硬件、耗材及无菌操作技术,其中特别值得注意的是硬件,硬件是最开始的基础模块,就跟造房子一样,房子(硬件)要坚固且布局合理,配套家具(耗材)及生活使用(无菌操作技术),才能让无菌技术发挥充分。以下要求可供参考:
1、硬件应依产线无菌要求设计、选型及采购
2、首次确认/验证非常重要,并注意制定合理的再确认/验证周期
3、确保定期且有效的维护维保
4、确保人员的正确操作
5、确保计量器具定期校验,如检测探头,配件定期检测更换,如HEPA
举 例
如在T细胞分离、活化、修饰改造及扩增阶段使用的生物安全柜,其最重要的功能就是确保洁净环境并进行生物保护。其排风系统是负压外排式,既保护内环境:产品,又保护外环境:操作人员,减少由于气溶胶暴露导致培养物交叉污染及人员感染。
虽然在进行供体采集前,会对供者进行身体健康及传染病检查,但在生产过程中依旧难以避免产品被污染的风险。因此在整个产品生命周期中,需要严格控制细胞被污染的可能,不仅仅是传染病的污染也包括微生物的污染。
那么对于生物安全柜的筛选,
首先,必须考虑生物安全柜的安全等级以满足生物防护需求,
再者,日常的使用及维护时,也应注意以下内容:
1、定期检查HEPA泄漏率,并日常注意压差变化
2、定期检测工作风速
3、使用前后紫外灯照射消毒
4、使用时注意尽量不要阻挡回风口
5、使用后及时清洁,并定期清洁操作台下方,清洁时注意保护HPEA
6、注意发生污染后安全柜的处理方法。

三、无菌工艺的合理性及稳定性
合理稳定的无菌工艺是对产品安全性的保障,那么对于无菌工艺的确认,培养基模拟试验尤为重要,其目的为:
1、对无菌工艺过程无菌保证水平的综合评估(包括设备、人员、操作、生产环境等)
2、对无菌操作人员进行资格确认
3、确认进行重大变更后对无菌工艺的影响
4、作为问题调查的手段
5、综合反映生产线整体的无菌保证情况,但无法体现具体某批产品或某个产品的无菌性
在GMP细胞治疗附录第二十六条,专门对培养基模拟试验进行了描述。首次培养基模拟试验前,建议绘制流程图,通过分析确定可能造成产品污染的风险因素,特别是一些高风险操作步骤,风险分析中应覆盖产线中的暴露设计、设备、人员、环境等各方面。
设计试验方案时应结合生产、QA及QC微生物岗位人员的意见,共同制定及修订。在成功通过培养基模拟试验的首次验证后,可采用括号法或矩阵法或联用方法每班次半年再进行一次培养基模拟试验,关于括号法及矩阵法可参考ICH Q1D以及EU GMP 附录15。
举 例
如细胞治疗产品生产过程中细胞培养过程时间较长,进行模拟时会占用较长时间,可使用风险评估方式进行评价,以缩短某些操作的时长,特别应注意培养环境,确保符合法规的洁净度要求,免受微生物污染。
另外培养温度也是关键点,一方面,无菌工艺中的污染微生物培养需要稳定的温度,另一方面,在实际产品操作过程中,细胞治疗产品的治疗机理是通过细胞本身的生物学活性产生的,而人体细胞通常对温度等因素比较敏感,因此在生产操作、检验等过程中,均应确保稳定的温度。

无菌管控管理的难点
软件:人员无菌意识薄弱
背后的原理一知半解,无菌操作无法举一反三
硬件:无菌硬件技术有待提高
硬件(含设备软件)不足,人工操作过多
体系:缺少系统的无菌保证体系运维
无菌保证SME专家缺失,出问题返过去查,时间长且复杂
总结
细胞治疗产品,生产过程非常个性化,原始样本的获取,需要从独立的人体获得,产成品最终再次回到人体,患者一般都是重大疾病,其本身对于外源污染的抵御能力就较弱。因此,在产品的制备过程中,安全性非常关键,无菌防控的良好管理,可以有效预防外源污染的引入,减少产品制备中相关偏差导致的不良品。